
【题目】如图表示两个常见固氮反应的平衡常数对数值(lgK)与温度的关系:①N2+3H22NH3;②N2+O22NO。根据图中的数据判断下列说法正确的是

A.升温,反应①的速率减小反应②的速率增大
B.反应①是放热反应
C.可以在常温下利用反应①进行工业固氮
D.曲线的交点表示反应①和反应②体系中 N2 的转化率相等
【答案】B
【解析】
根据图象①可知,温度越高,平衡常数对数值(lgK) 越小,平衡常数越小,说明升高温度,平衡逆向移动,N2+3H22NH3的正反应是放热反应;同理,②的温度越高,平衡常数越大,说明升高温度,平衡正向移动,N2+O22NO的正反应是吸热反应,据此分析解答。
A.升高温度,无论是放热反应还是吸热反应,反应速率都增大,故A错误;
B.根据上述分析可知,温度越高,①的平衡常数越小,说明升高温度,平衡逆向移动,反应①是放热反应,故B正确;
C.在常温下,反应①的平衡常数虽然很大,但反应速率太慢,不适合工业生产,故C错误;
D.在1000℃时,反应①和反应②的平衡常数对数值(lgK)相等,而不是N2的转化率相等,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】为了探究化学能与热能的转化,某实验小组设计了如下图所示的三套实验装置:
Ⅰ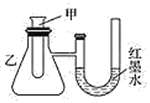 Ⅱ
Ⅱ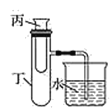 Ⅲ
Ⅲ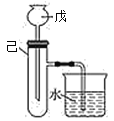
(1)上述装置中,不能验证“某固液不加热反应是吸热反应还是放热反应”的装置是______(填装置序号)。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管中加入适量金属锌与稀硫酸,U形管中可观察到的现象是_______。说明该反应属于___(填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在丙试管中进行)。
①若M为氢氧化钠,则实验过程中烧杯中可观察到的现象是_________。
②若观察到烧杯中导管产生一段水柱,则说明M溶于水_____(填“一定是放热反应”、“一定是吸热反应”、“可能是放热反应”、“可能是吸热反应”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸与金属反应时,浓度越稀还原产物价态越低。现用一定量的铝粉与镁粉组成的混合物与100mL硝酸钾溶液与硫酸组成的混合溶液充分反应,反应过程中无任何气体放出,向反应后的溶液中逐滴加入4.00mol/L的NaOH溶液,加入的溶液体积与产生的沉淀质量的关系如图所示:
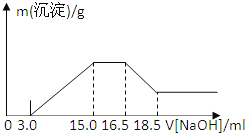
下列结论正确的是( )
A.铝与混合溶液反应的离子方程式为8Al+30H++3NO3=8Al3++3NH4++9H2O
B.参加反应硝酸根离子物质的量为0.06 mol
C.参加反应的铝与镁的质量之比为4:3
D.混合液中硫酸的物质的量的浓度为0.72 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定量的CuCl2产品投入Na2CO3溶液中,充分反应生得到一种仅含四种元素的不溶性盐X,并产生气体CO2。设计如下实验探究X的组成和性质。已知各步反应所需试剂均过量,请回答:

(1)混合气体的成分是______________;X的化学式为__________________。
(2)写出CuCl2与Na2CO3反应生成X的离子方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子电池的应用很广,其正极材料可再生利用。某离子电池正极材料有钴酸锂(LiCoO2),导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为:6C+xLi++xe-=LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件末给出)。
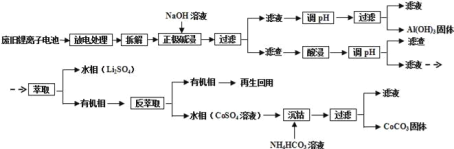
(1) LiCoO2中,Co元素的化合价为____________。
(2)写出“正极碱浸”中发生反应的离子方程式_____________________________________。
(3)采用H2SO4和H2O2的混合液进行“酸浸”,一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式:__________________________________________。可用盐酸代替H2SO4和H2O2的混合液,但缺点是___________________________。
(4)写出“沉钴“过程中发生反应的化学方程式_________________________________。
(5)充放电过程中,发生LiCoO2与LixCoO2之同的转化,写出放电时电池反应方程式_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1mol/LNaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )

A.a点溶液中:c(Na+)>c(A-)>c(H+)>c(HA)
B.a、c两点溶液中水的电离程度相同
C.b点溶液中:c(Na+)=c(A-)+c(HA)
D.c点溶液中:c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,①pH=11的氨水;②pH=11的NaOH溶液;③pH=3的醋酸;④pH=3的硫酸,下列有关说法不正确的是
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH①>②>④>③
C.①、④两溶液混合后,若溶液呈中性,则所得溶液中2c(NH4+)=c(SO42-)
D.V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=11:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。
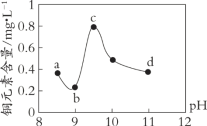
查阅资料,平衡I:Cu(OH)2 + 4NH3 ![]() [Cu(NH3)4]2+ + 2OH-;
[Cu(NH3)4]2+ + 2OH-;
平衡II:Cu(OH)2 + 2OH- ![]() [Cu(OH-)4]2-
[Cu(OH-)4]2-
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/ mg·L-1 | 72 | ≤0.5 |
NH4+/ mg·L-1 | 2632 | ≤15 |
下列说法不正确的是
A. 废水中Cu2+处理的最佳pH约为9
B. b~c段:随pH升高,Cu(OH)2的量增加,平衡I正向移动,铜元素含量上升
C. c~d段:随pH升高,c(OH-)增加,平衡I逆向移动,铜元素含量下降
D. d点以后,随c(OH-)增加,铜元素含量可能上升
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol·L1的HA溶液中逐滴加入0.1mol·L1的NaOH溶液,溶液中水所电离的c水(H+)随加入NaOH溶液体积的变化如图所示,下列说法正确的是
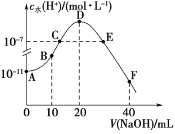
A.HA的电离常数Ka约为1×105
B.B点的溶液中粒子浓度满足关系:c(HA)>c(Na+)>c(A)
C.C、E两点因为对水的电离的抑制作用和促进作用相同,所以溶液均呈中性
D.F点的溶液呈碱性,粒子浓度满足关系c(OH)=c(HA)+c(A)+c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com