
把100mL 2mol/L的H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应速率而不影响生成H2的总量,可在反应物中加入适量的
A.硫酸铜溶液 B.硝酸钠溶液 C.醋酸钠溶液 D.氢氧化钠溶液
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:选择题
(原创)用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,46g NO2中含有的分子数为NA
B.通常状况下,14g CO含有的电子数目为7NA
C.1L 0.2 mol/L的CH3COOH溶液中,H+ 数目为0.2NA
D.0.1mol Cu 和与40mL 10mol/L硝酸反应后,溶液中的NO3-数目为0.2NA
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省高三仿真测试理科综合化学试卷(解析版) 题型:选择题
铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如图所示。下列说法正确的是
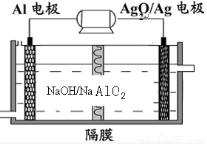
A.电池负极反应式2Ag+2OH--2e-= Ag 2O+H2O
B.放电时电池负极附近PH减小
C.电池总反应式2Al+3Ag2O+6H+ =2Al3++6Ag+3H2O
D.电解液中Na+通过隔膜由右向左移动
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省五校第二学期期末联考高一化学试卷(解析版) 题型:选择题
关于如图所示的原电池,下列说法正确的是
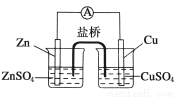
A. 锌电极发生还原反应,铜电极发生氧化反应
B.盐桥中的阴离子向硫酸铜溶液中迁移
C.电子从锌电极通过电流计流向铜电极
D.铜电极上发生的电极反应为2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省五校第二学期期末联考高一化学试卷(解析版) 题型:选择题
下列各组中,不管以何种比例混合,只要总质量一定,充分燃烧后生成的二氧化碳物质的量不变的是
A.乙烯(C2H4)和乙炔(C2H2) B.乙醇和丙醇(CH3CH2CH2OH)
C.乙醇和乙醚(C2H5OC2H5) D.甲醛( HCHO)和乙酸
查看答案和解析>>
科目:高中化学 来源:2013-2014福建龙岩市毕业联合考试理综化学试卷(解析版) 题型:实验题
(14分)曾经有一种固氮的方法:1100°C通N2和CaC2反应得到CaCN2 。
已知:CaCN2+3H2O = 2NH3+CaCO3 ;CaC2+2H2O = C2H2↑+Ca(OH)2


(1)某同学采用以下装置(加热和夹持仪器已略去)制取少量的CaCN2
①U形管中盛放的物质是 (填一种);
② (填“能”或“不能”)用普通玻璃管代替图中石英管;
(2)检验反应后的固体(用W表示)中含有氮元素该同学将适量W溶于水,有气泡产生,说明固体中含有氮元素,该结论不正确。若要得出正确结论,还需进行的实验是 。
(3)测定W中CaCN2的质量分数
步骤Ⅰ:按如图所示装置(夹持仪器已略去)进行实验:关闭弹簧夹,将漏斗中溶液逐滴加入到三颈瓶中,当W反应完全后,打开弹簧夹,通入氮气,直至氨气被200mL0.1 mol·L-1硫酸完全吸收。
步骤Ⅱ:准确量取烧杯中溶液20.00mL置于锥形瓶中,滴入几滴指示剂,用cmol·L-1NaOH溶液滴定过量的硫酸,实验测得消耗标准溶液的平均体积为vmL。
已知三种常用指示剂变色pH范围如下:
指示剂 | a | b | c |
变色pH范围 | 3.1~4.4 | 8.0~10.0 | 4.4~6.2 |
说明 | pH<3.1显红色 pH>4.4显黄色 | pH<8.0显无色 pH>10.0显红色 | pH<4.4显红色 pH>6.2显黄色 |
①上述滴定过程中,不宜选用的指示剂是 (填字母序号);
②烧杯中最终吸收氨气的物质的量为 mol;经进一步计算可求得W中CaCN2质量分数。
③上述实验所得结果明显偏小,若不考虑装置的气密性和操作误差,则导致结果偏小的可能原因是
(写1种)。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建龙岩市毕业联合考试理综化学试卷(解析版) 题型:选择题
在K2CrO4的溶液中存在着如下的平衡:2CrO42- + 2H+ Cr2O72- + H2O, K=1×1014。若用0.05mol K2Cr2O7配制成1 L K2CrO4溶液,其中c(Cr2O72-)<10-5mol/L,则所配溶液的pH
Cr2O72- + H2O, K=1×1014。若用0.05mol K2Cr2O7配制成1 L K2CrO4溶液,其中c(Cr2O72-)<10-5mol/L,则所配溶液的pH
A.>7 B.<7 C.=7 D.无法确定
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州市高三5月综合练习理综化学试卷(解析版) 题型:填空题
(15分)四种主族元素的性质或结构信息如下:
元素编号 | 相关信息 |
X | 地壳中含量最大的金属元素;元素最高价为+3价。 |
Y | 原子最外层电子数是电子层数的2倍,最外层电子数是X最外层电子数的2倍。 |
Z | 同周期主族元素中原子半径最小,常温下单质呈液态。 |
M | 能从海水中提取的金属元素,单质可在氮气或二氧化碳中燃烧。 |
(1)M的原子结构示意图是 ;上述元素最高价氧化物对应的水化物碱性最强的是(写分子式) (元素用元素符号表示,下同!)。
(2)Y单质溶于热浓的硫酸产生的气体的化学式为 。
(3)能体现Z单质比Y单质活泼性强的一个化学方程式: 。
(4)常温下,不能与X的单质持续发生反应的是(填选项序号) 。
A.CuSO4溶液 B.Fe2O3 C.浓硫酸 D.NaOH溶液 E.Na2CO3固体
(5)铁元素与Z元素形成化合物FeZ3,FeZ3溶液按下图所示进行试验。装置通电后,连接电源 (填“正极”或“负极”)碳棒边的煤油颜色将变深,另一碳棒附近溶液将出现的现象是 。
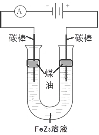
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县第二学期期中考试高一化学试卷(解析版) 题型:选择题
化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( )
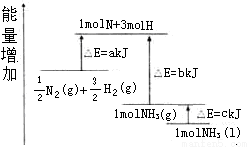
A.N2(g)+3H2(g)=2NH3(1);△H=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g)=2NH3(g);△H=2(b-a)kJ·mol-1
C. N2(g)+
N2(g)+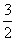 H2(g)=NH3(1);△H=(h+c-a)kJ·mol-1
H2(g)=NH3(1);△H=(h+c-a)kJ·mol-1
D. N2(g)+
N2(g)+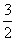 H2(g)=NH3(g);△H=(a+b)kJ·mol-1
H2(g)=NH3(g);△H=(a+b)kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com