
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g)+2H2(g) CH3OH(g) ΔH
CH3OH(g) ΔH
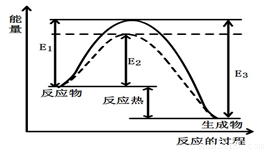
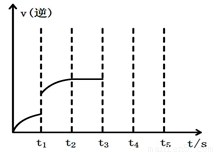
图1 (图中表示生成1mol物质时的能量) 图2
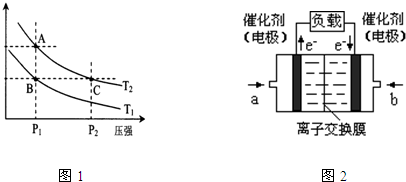
(1)根据图1请写出合成甲醇的热化学方程式
(2)该反应的逆反应速率随时间变化的关系如上图2。t1时改变了某种条件,改变的条件可能是 。
(3)判断反应达到平衡状态的依据是 (填字母序号)。
A.2v(H2)(逆) =v(CO)(正) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
(4)在一定温度下,若将4a mol H2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol CO、2amol H2和amol CH3OH,判断平衡移动的方向是 (“正向移动”“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度 (填“增大”、“不变”或“减小”)。
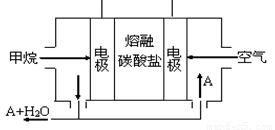
(5)某甲烷燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见图)。A物质的化学式是_________;该原电池的负极反应式可表示为 。
(11分)(1)CO(g) + 2H2(g)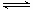 CH3OH(g) ΔH=(E1-E3)或-(E3-E1)kJ?mol-1
CH3OH(g) ΔH=(E1-E3)或-(E3-E1)kJ?mol-1
(2分,见错不得分)
(2)加压、等倍增加反应物和生成物、增加甲醇浓度、升高温度、使用催化剂等(1分)(任答一个合理答案给分。注:t1时刻不能确认是否平衡)
(3)CD(2分,见错不给分) (4)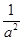 (1分)正向移动(1分)增大(1分)
(1分)正向移动(1分)增大(1分)
(5)A为CO2(1分)CH4+4CO32--8e-=5CO2+2H2O (2分)
【解析】
试题分析:(1)根据图像可知,反应物的总能量高于生成物的总能量,即该反应是放热反应,△H=(E1-E3)或-(E3-E1)kJ/mol,则该反应的热化学反应方程式为CO(g) + 2H2(g) CH3OH(g) ΔH=(E1-E3)或-(E3-E1)kJ/mol。
CH3OH(g) ΔH=(E1-E3)或-(E3-E1)kJ/mol。
(2)t1时逆反应速率突然增大,所以改变的条件可能是加压、等倍增加反应物和生成物、增加甲醇浓度、升高温度、使用催化剂等。
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项D正确。A中反应速率的方向相反,但不能满足速率之比是相应的化学计量数之比,不正确。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,B不正确;混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以C可以说明。平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,E不能说明,因此答案选CD。
(4)
CO(g) + 2H2(g) CH3OH(g)
CH3OH(g)
起始浓度(mol/L) a 2a 0
转化浓度(mol/L) 0.5a a 0.5a
平衡浓度(mol/L) 0.5a a 0.5a
所以平衡常数K=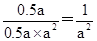
若平衡时再向该容器中投入a
mol CO、2amol H2和amol CH3OH,则此时 <
<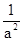 ,所以反应向正反应方向进行。由于CO不能完全转化为生成物,所以与原平衡相比,CO的物质的量浓度增大。
,所以反应向正反应方向进行。由于CO不能完全转化为生成物,所以与原平衡相比,CO的物质的量浓度增大。
(5)原电池中负极失去电子,正极得到电子,因此甲烷在负极通入,氧气在正极通入。由于电解质是熔融的碳酸盐,所以负极和正极的电极反应式分别是CH4+4CO32--8e-=5CO2+2H2O、2O2+8e-+4CO2=4CO32-,这说明A物质的化学式是CO2。
考点:考查热化学方程式的书写、外界条件对反应速率的影响、平衡常数的有关计算和应用、平衡状态的判断、电极反应式的书写等
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力,提升学生的学科素养。


科目:高中化学 来源: 题型:阅读理解
 CH3OH(g)△H
CH3OH(g)△H| 温度 | 250°C | 300°C | 350°C |
| K | 2.041 | 0.270 | 0.012 |
| V2 |
| a2 |
| V2 |
| a2 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2moL H2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 时 的 数 据 |
CH3OH浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
| 平衡时数据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com