
【题目】糖类、油脂、蛋白质是人类重要的营养物质。下列有关这三类物质的说法正确的是
A.均是天然高分子化合物B.均只由C、H、O三种元素组成
C.油脂的水解反应又叫皂化反应D.淀粉、油脂、蛋白质在一定条件下均能发生水解反应
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
【题目】某同学做如下实验:
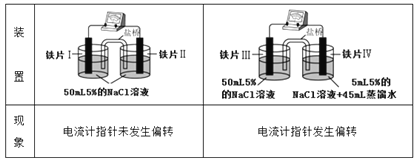
已知K3[Fe(CN)6]遇Fe2+生成深蓝色沉淀,则下列说法正确的是
A. “电流计指针未发生偏转”,说明铁片I、铁片II均未被腐蚀
B. 用K3[Fe(CN)6]溶液检验铁片III、IV附近溶液,可判断电池的正、负极
C. 铁片I、III所处的电解质溶液浓度相同,二者的腐蚀速率相等
D. 铁片IV的电极反应式为Fe-3e-=Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理,对于消除环境污染有重要意义。回答下列问题:
(1)已知2NO(g) +O2(g)![]() -2NO2(g) △H的反应历程分两步:
-2NO2(g) △H的反应历程分两步:
①2NO( g )![]() N2O2 (g)( 快 ) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
N2O2 (g)( 快 ) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
②N2O2 (g)+ O2 (g) ![]() 2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小: E1__ E2 (填“>”、“<”或“=”) 其判断理由是__________;2NO(g) +O2(g)![]() 2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g)
2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g) ![]() 2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
(2)①以乙烯(C2H4)作为还原剂脱硝(NO),其脱硝机理如左下图所示,若反应中n(NO): n(O2) =2 :1,则总反应的化学方程式为_______________;脱硝率与温度、负载率(分子筛中催化剂的质量分数) 的关系如右下图,为达到最佳脱硝效果,应采用的条件是________________。
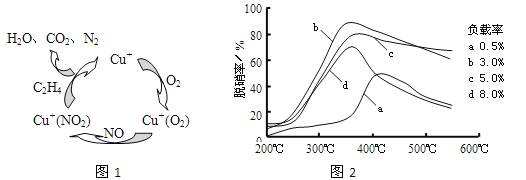
②用NO可直接催化NO分解生成N2、O2,将其反应机理补充完整(Vo代表氧空穴):
2Ni2++2Vo+2NO→2Ni3++2O-+N2 2O-→O2-+1/2O2+Vo ______________
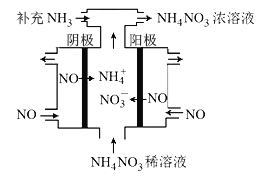
(3)电解NO可制备NH4NO3,其工作原理如图所示,阴极的电极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验,不能说明乙酸是弱电解质的是
A. 常温时,测得乙酸钠溶液的pH>7
B. 常温时,测得0.1 mol·L-1乙酸溶液的pH约为3
C. 乙酸溶液与大理石反应产生气泡
D. 相同温度下,测得同物质的量浓度的乙酸溶液的导电性比盐酸溶液弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁发生析氢腐蚀时,正极上发生的电极反应是
A. 2H++2e-=H2↑ B. Fe2++2e-=Fe
C. 2H2O+O2+4e-=4OH- D. Fe3++e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为金属单质,它们之间能发生如下反应(部分产物未标出)。
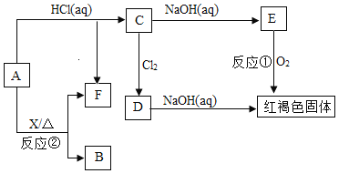
请根据以上信息回答下列问题:
(1)写出物质B的化学式:________。
(2)写出下列反应的化学方程式:
反应①______________________________________。
反应②_______________________________________。
(3)写出下列反应的离子方程式:反应C→D________________________。
(4)检验D中阳离子的方法:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某碳酸溶液中的H2CO3、HCO3-、CO23-的物质的量分数δ随pH的变化如下图所示。下列叙述错误的是( )
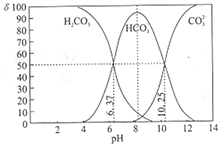
A. 当溶液中δ(HCO3-)达到最大时:c(H2CO3)>c(CO32-)
B. Ka2(H2CO3)的数量级为10-11
C. 调节溶液的pH由8~10的过程中![]() 减小
减小
D. 加入NaOH使溶液pH=9时,主要反应为HCO3-+OH-=CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有11.2 g KOH的稀溶液与1 L 0.1 mol/L的H2SO4溶液反应,放出11.46 kJ的热量,表示该反应中和热的化学方程式为( )
A.KOH(aq)+H2SO4(aq)===K2SO4(aq)+H2O(l) Δ H=-11.46 kJ/mol
B.2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l) ΔH=-11.46 kJ/mol
C.2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ/mol
D.KOH(aq)+![]() H2SO4(aq)===K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
H2SO4(aq)===K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com