
 CO2(g)+H2(g) ��H��0����850��ʱ��ƽ�ⳣ��K=1��
CO2(g)+H2(g) ��H��0����850��ʱ��ƽ�ⳣ��K=1��
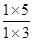 ��1����˷�Ӧ���淴Ӧ������С�
��1����˷�Ӧ���淴Ӧ������С� ��1�����x��3�����xӦ�����������0��x��3��
��1�����x��3�����xӦ�����������0��x��3��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| 3 |
| 2 |
| A��-2491kJ?mol-1 | B��+859kJ?mol-1 |
| C��-1403kJ?mol-1 | D��-859kJ?mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��pH=4�Ĵ����У�c��H+��=4��0molL��1 |
| B������С�մ���Һ�У�c��Na+��= c��HCO3���� |
| C������ʳ��ˮ�У�c��Na+��+ c��H+��= c��Cl����+c��OH���� |
| D��pH=12�Ĵ�����Һ�У�c��OH����=1��0��10��2mol?L��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��pH=4�Ĵ����У�c��H+��=4.0mol��L-1 |
| B������С�մ���Һ�У�c��Na+��= c��HCO3-�� |
| C������ʳ��ˮ�У�c��Na+��+ c��H+��= c��Cl-��+c��OH-�� |
| D��pH=12�Ĵ�����Һ�У�c��OH-��=1.0��10-2mol��L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A��II��ʾ���ǵζ���������� |
| B��pH=7ʱ���ζ��������ĵ�V(NaOH)С��20 mL |
| C��V(NaOH)=" 20.00" mLʱ��������Һ��c(Cl-)= C(CH3COO-) |
| D��V(NaOH) ="10.00" mLʱ��������Һ��c(Na+)> C(CH3COO-)> c(H+)> c(OH-) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ��� | �������������/mL | �������Ƶ����/mL | ��Һ��pH |
| �� | 33.00 | 0.00 | 8 |
| �� | 33.00 | x | 7 |
| �� | 33.00 | 33.00 | 6 |
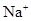 )��c(
)��c(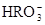 )��c(
)��c(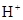 )��c(
)��c(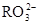 )��c(
)��c(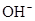 )
)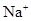 )��c(
)��c(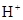 )��c(
)��c(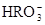 )��2c(
)��2c(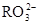 )��c(
)��c(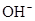 )
)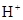 )��c(
)��c(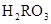 )��c(
)��c(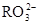 )��c(
)��c(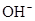 )
)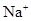 )��c(
)��c(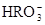 )��c(
)��c(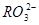 )�ֱ����
)�ֱ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����������ˮ�������c��H+��=1.0��10-3mol/L |
| B����ˮϡ�͵�ԭ��Һ�����100����������Һ��pHΪ5 |
| C����ͬ�¶��£�pH=3��CH3COOH��Һ�����ʵ���Ũ�����������ͬ |
| D�����������������Zn������H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������ˮ�еμ�ŨH2SO4��KW���� |
| B��CaCO3������ϡ���ᣬҲ�����ڴ��� |
| C����Na2Sϡ��Һ�У�c(H��)��c(OH��)��2c(H2S)��c(HS��) |
| D��NaCl��Һ��CH3COONH4��Һ�������ԣ�����Һ��ˮ�ĵ���̶���ͬ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com