
| A. | 若X为O,则Y、X形成的常见化合物一定是离子化合物 | |
| B. | 若X是Na,则Z的最高正价一定是偶数 | |
| C. | 若Y为O,则非金属性:X<Y<Z | |
| D. | 若Y为Na,则X、Z不可能是同一主族元素 |
分析 Z的最高价氧化物对应的水化物是中学常见的强酸,则Z可能为N、S、Cl,短周期主族元素aX、bY、cZ.已知a+c=2b,则X和Z的原子序数只能同时为奇数或者同时为偶数,以此来解答.
解答 解:原子序数a+c=2b,则X和Z的原子序数只能同时为奇数或者同时为偶数,Z的最高价氧化物对应水化物是强酸,Z只能是N,S,Cl(短周期)等元素,
A.X是O,因为O原子序数是8,偶数,则Z只能是S,Y的原子序数为$\frac{8+16}{2}$=12,Y是Mg,MgO是离子化合物,故A正确;
B.X是Na,则Z可为Cl,最高价是奇数,故B错误;
C.Y是O,则a+c=16,只有Z为N,X为F满足,非金属性:F>O>N,即:X>Y>Z,故C错误;
D.Y是Na,则a+c=22,Z可为N,Y为P元素,N和P是同一主族元素,7+15=22满足前述条件,故D错误.
故选A.
点评 本题考查原子结构与元素周期律的关系,为高频考点,注意根据原子序数的关系判断元素的种类是解答该题的关键,题目难度中等.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| 碳酸钙的状态 | 盐酸的浓度 | 反应的温度 | |
| A. | 块状 | 1 mol/L | 25℃ |
| B. | 块状 | 6 mol/L | 40℃ |
| C. | 粉末 | 1 mol/L | 25℃ |
| D. | 粉末 | 6 mol/L | 40℃ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH和金属铝 | B. | NaOH 和CO2 | C. | Na2CO3和HCl | D. | Na和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷是天然气的主要成分,能发生取代反应,但不能发生氧化反应 | |
| B. | 实验室中,可用金属钠检验乙醇中是否含有水 | |
| C. | 只用水无法鉴别苯、乙酸和四氯化碳 | |
| D. | 植物油不能用于萃取溴水中的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图2 中反应速率最快的是容器丙 | |
| B. | 图1 中容器乙的反应可能使用了催化剂 | |
| C. | 图l 中容器乙0~5 min时间内v${\;}_{({N}_{2})}$=0.012mol/(L•min) | |
| D. | 图1 中容器丙内反应的平衡常数为2.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 现象 |
| Ⅰ.向盛有4.0gNa2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生的气体能使带火星木条复燃,固体全部溶解后,得到的无色溶液a |
| Ⅱ.向溶液a中滴入两滴酚酞 | 溶液变红,10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
| Ⅲ.向溶液中加入少量MnO2粉末 | 又有大量气泡产生,产生的气体也能使带火星木条复燃 |
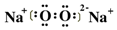 ,很明显,实验证实了溶液a中H2O2的存在,应用同位素示踪原理可以表
,很明显,实验证实了溶液a中H2O2的存在,应用同位素示踪原理可以表查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com