
【题目】AG均分别代表一种物质,结合如图所示的转化关系(框图中的部分产物已略去),回答下列问题:

已知:I.天然有机高分子化合物A,是一种遇到碘水能变蓝的多糖;
Ⅱ. H为丙三醇(CH2OH-CHOH-CH2OH),G有香味。
(1)①C→E的反应类型为_________。
②与出D→C的化学反应方程式:_________。
③写出F与H以物质的量3:1浓硫酸、加热条件下发生的化学方程式:_____。
(2)人在剧列运动后腿和胳膊会感到酸胀或疼痛,原因之一是B(C6H12O6)→2C3H6O3(乳酸)。某研究小组为了研究乳酸(无色液体,与水混溶)的性质,做了如下实验:
①取90g乳酸饱和NaHCO3溶液反应,测得生成的气体体积为22.4L(标准状况下);
②另取90g乳酚与过量的金属钠反应,测得生成的气体体积为22.4L(标准状况下)。
由以上实验推知乳酸分子含有的官能团名称________;试写出所有符合上述条件有机物的同分异构体的结构简式________。
【答案】氧化反应 CH2=CH2+H2O![]() CH3CH2OH CH2OH-CHOH-CH2OH+3CH3COOH
CH3CH2OH CH2OH-CHOH-CH2OH+3CH3COOH![]()
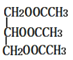 +3H2O 羧基、羟基 CH3CHOHCOOH、HOCH2CH2COOH
+3H2O 羧基、羟基 CH3CHOHCOOH、HOCH2CH2COOH
【解析】
A是一种遇到碘单质能变蓝的多糖,则A为淀粉,水解生成B为葡萄糖,由转化关系可知C为CH3CH2OH,D与H2O在一定条件下反应产生C,则D为乙烯,结构简式为CH2=CH2,乙醇催化氧化产生的E为CH3CHO,E催化氧化产生的F为CH3COOH,则G为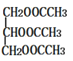 ,以此解答该题。
,以此解答该题。
由上述分析可知:A为淀粉,B为葡萄糖,C为CH3CH2OH,D为CH2=CH2,E为CH3CHO,F为CH3COOH,G为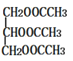 。
。
(1)①C为CH3CH2OH,CH3CH2OH在Cu催化下发生氧化反应产生CH3CHO,所以乙醇变乙醛的反应为氧化反应;
②乙烯与水反应的化学方程式为:CH2=CH2+H2O![]() CH3CH2OH;
CH3CH2OH;
③F是乙酸,H是丙三醇,F与H以物质的量比3:1在浓硫酸、加热条件下发生的化学方程式为CH2OH-CHOH-CH2OH+3CH3COOH![]()
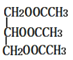 +3H2O;
+3H2O;
(2)①乳酸相对分子质量是90,90g乳酸的物质的量是1mol,取90g乳酸与过量的饱和NaHCO3溶液反应,测得生成22.4L标准状况下即1mol的气体,说明乳酸分子中含有1个羧基;②另取90g乳酸与过量的金属钠反应,测得生成22.4L标准状况下即1mol的气体,则说明乳酸分子中含有1个羧基、1个羟基,则乳酸可能的结构为CH3CHOHCOOH、HOCH2CH2COOH。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是
A.原电池的正极和电解池的阳极所发生的反应
B.原电池的正极和电解池的阴极所发生的反应
C.原电池的负极和电解池的阳极所发生的反应
D.原电池的负极和电解池的阴极所发生的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳、氮及其化合物的转化对于环境的改善有重大意义。
(1)氧化还原法消除NOx的转化如下:NO![]() NO2
NO2![]() N2
N2
已知:NO(g)+O3(g)=NO2(g)+O2(g) ΔH=-200.9 kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=-116.2 kJ·mol-1
则反应Ⅰ的热化学方程式为_____________________________________________。
(2)有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g) ΔH>0,请你分析该设想能否实现并说明理由是____________________________________________。
(3)甲酸的电离平衡常数Ka=1.70×10-4。向20 mL 0.1 mol·L-1的甲酸钠溶液中滴加10 mL 0.1 mol·L-1的盐酸,混合液呈________(填“酸”或“碱”)性,溶液中离子浓度从大到小的顺序为______________________。
(4)活性炭也可用于处理汽车尾气中的NO。在2 L恒容密闭容器中加入0.100 0 mol NO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如表所示:
温度 | 固体活性炭/mol | NO/mol | A/mol | B/mol |
200 ℃ | 2.000 | 0.040 0 | 0.030 0 | 0.030 0 |
335 ℃ | 2.005 | 0.050 0 | 0.025 0 | 0.025 0 |
①该反应的正反应为________(填“吸热”或“放热”)反应。
②200 ℃时,平衡后向恒容容器中再充入0.1 mol NO,再次平衡后,NO的百分含量将________(填“增大”“减小”或“不变”)。
③计算反应在335 ℃时的平衡常数为________。
(5)工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至15.5~26.5℃后用氨水吸收过量的CO2,该反应的化学方程式为_______________________。在用氨水吸收前,烟气需冷却至15.5~26.5℃的可能原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解释下列反应原理的离子方程式正确的是
A. 用加热的方法降低自来水中钙离子浓度:Ca2++2HCO3-![]() CaCO3↓+H2O+CO2↑
CaCO3↓+H2O+CO2↑
B. 向CH2BrCOOH中加入足量的NaOH溶液并加热:CH2BrCOOH+OH-→CH2BrCOO-+H2O
C. 向Mg(HCO3)2溶液中加入足量的NaOH溶液:Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+H2O
D. 在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2O(g)=2 H2(g)+O2(g) ΔH=+496kJ·mol-1 。断开1 mol H—H键、O=O键分别需要吸收436 kJ、498 kJ的热量,则断开1 molO—H键需要吸收的热量为( )
A. 462 kJB. 469 kJC. 362 kJD. 466.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图A、B是等体积容器,K是开关,活塞可以左右移动。在一定温度下,关闭K,向A中通入一定量的NO2。发生:2NO2(g)![]() N2O4(g);△H<0。则以下说法不正确的是
N2O4(g);△H<0。则以下说法不正确的是

A. 保持活塞位置不变,打开K,体系中气体颜色先变浅、然后略加深
B. 打开K一会,再关闭它,向右推动活塞,最后A容器的气体颜色比B的浅
C. 保持活塞位置不变,打开K一会,再关闭它,把A容器加热,A中气体颜色比B中深
D. 打开K一会,再关闭它,向B中通入氩气,B中气体颜色不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗,其制备过程如图所示,下列叙述不合理的是
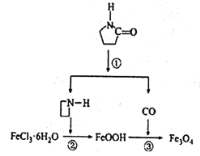
A. 在反应②中,![]() 的作用可能是促进氯化铁水解
的作用可能是促进氯化铁水解
B. 直接加热FeCl3溶液也可以得到Fe3O4
C. 反应③的化学方程式是6FeOOH+CO=2Fe3O4+3H2O+CO2
D. 纳米四氧化三铁形成的分散系,有可能产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为从海带中提碘生产的实验室模拟流程。试回答下列问题:
(1)实验操作中所用玻璃仪器为酒精灯、烧杯、普通漏斗、牛角管、锥形瓶、蒸馏烧瓶等。若要完成操作1,还缺少的玻璃仪器有 ,该仪器的作用为 ;操作2的名称为 ;若要完成操作3,还缺少的玻璃仪器有 。
(2)实验室用二氧化锰制氯气的化学方程式为 。
(3)弃液B中滴入淀粉液,溶液呈蓝色,但通入二氧化硫后蓝色褪去,写出该过程中发生反应的化学方程式并用双线桥标明电子转移的方向和数目 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为A、B、C三种物质的溶解度曲线,请据图判断下列叙述中不正确的是

A. t1℃时,30gB物质溶解在50g水中形成80g溶液
B. t2℃时,不能配成溶质质量分数相同的三种物质的饱和溶液
C. 当A中混有少量C时,可采用冷却热饱和溶液法提纯A
D. A、C两种物质的饱和溶液从t2℃降到t1℃时,溶液的溶质质量分数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com