
【题目】已知2H2O(g)=2 H2(g)+O2(g) ΔH=+496kJ·mol-1 。断开1 mol H—H键、O=O键分别需要吸收436 kJ、498 kJ的热量,则断开1 molO—H键需要吸收的热量为( )
A. 462 kJB. 469 kJC. 362 kJD. 466.5 kJ
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.电解熔融氧化铝制取金属铝,氧化铝只被还原
B.电解熔融NaCl制取Na,在阴极得到Na
C.电解水时,在相同条件下,阳极和阴极产生的气体体积之比为2:1
D.电解食盐水制H2、Cl2的过程是把化学能转变为电能的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】定量分析是化学实验中重要的组成部分。
Ⅰ.中和热的测定:在实验室中,用50 mL 0.40 mol/L的盐酸与50 mL 0.50mol/L的NaOH溶液反应测定中和热。假设此时溶液密度均为1 g/cm3,生成溶液的比容热c = 4.18 J/(g℃),实验起始温度为T1℃,终止温度为T2℃,则中和热△H=___kJ/mol。
Ⅱ.氧化还原滴定实验与中和滴定类似。为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。
(1)滴定原理为:(用离子方程式表示)___________。
(2)达到滴定终点时的颜色变化为___________ 。
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的___________读数为mL。

(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
实验序号 | ① | ② | ③ |
消耗KMnO4溶液体积/mL | 26.53 | 24.02 | 23.98 |
从上表可以看出,实验①中记录消耗KMnO4溶液的体积明显多于②③,其原因可能是 ______________________。
A.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
B.①滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,②③均用标准液润洗
C.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
D.①滴定用的锥形瓶用待测液润洗过,②③未润洗
(5)H2C2O4的物质的量浓度=______________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A. 工业制硫酸采用二氧化硫催化氧化,高温可以提高单位时间SO3的产量
B. 合成氨工业中使用铁触媒做催化剂
C. 用饱和食盐水除去氯气中氯化氢杂质
D. 容器中有2HI(g)![]() H2(g)+I2(g),增大压强颜色变深
H2(g)+I2(g),增大压强颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于A2(g)+3B2(g)![]() 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
A. v(A2)=0.8 mol·L-1·s-1 B. v(A2)=30 mol·L-1·min-1
C. v(AB3)=1.0 mol·L-1·s-1 D. v(B2)=1.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AG均分别代表一种物质,结合如图所示的转化关系(框图中的部分产物已略去),回答下列问题:

已知:I.天然有机高分子化合物A,是一种遇到碘水能变蓝的多糖;
Ⅱ. H为丙三醇(CH2OH-CHOH-CH2OH),G有香味。
(1)①C→E的反应类型为_________。
②与出D→C的化学反应方程式:_________。
③写出F与H以物质的量3:1浓硫酸、加热条件下发生的化学方程式:_____。
(2)人在剧列运动后腿和胳膊会感到酸胀或疼痛,原因之一是B(C6H12O6)→2C3H6O3(乳酸)。某研究小组为了研究乳酸(无色液体,与水混溶)的性质,做了如下实验:
①取90g乳酸饱和NaHCO3溶液反应,测得生成的气体体积为22.4L(标准状况下);
②另取90g乳酚与过量的金属钠反应,测得生成的气体体积为22.4L(标准状况下)。
由以上实验推知乳酸分子含有的官能团名称________;试写出所有符合上述条件有机物的同分异构体的结构简式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500oC下,在2L体积固定的密闭容器中发生反应:2A(g)![]() 2B(g)+C(g)若开始时只充入2molA气体,达平衡时,混合气体的总物质的量为2.4mol。(作答此题时,要求写出计算过程)
2B(g)+C(g)若开始时只充入2molA气体,达平衡时,混合气体的总物质的量为2.4mol。(作答此题时,要求写出计算过程)
(1)计算500oC时该反应的化学平衡常数?
(2)平衡时A的转化率是多少?
(3)设温度不变,反应前容器内压强为p0,则反应达平衡时,容器内压强是多少?(用p0表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银的冶炼有很多方法,在《天工开物》均有记载,而现代流行的“氰化法”,即 用NaCN溶液浸出矿石中的银的方法是常用的方法。该方法具备诸多优点:银的回收率高、对游离态和化合态的银均能浸出、对能源消耗相对较少,生产工艺简便等,但银化物通常有毒。其炼制工艺简介如下:
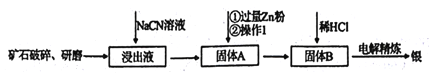
(1)矿石需要先进行破碎、研磨,其目的是_________。
(2)写出该工艺的一个明显的缺点____________。
(3)用NaCN浸泡矿石(该矿石是辉银矿,其主要成分是Ag2S)时,反应容器处于开口状态,产生的银以[Ag(CN)2]-形式存在,硫元素被氧化至最高价,试写出主要反应的离子方程式________。
(4)银往往和锌、铜、金等矿伴生,故氰化法得到的银中往往因含有上述金属而不纯净,需要进一步纯化,从而获得纯净的银。其中方法之一就是进行电解精炼,在精炼过程中,含有杂质的银作_______极(填“阴”或“阳”),该电极上发生的主要反应式为_____。
(5)有人提出了另外的提纯银的方案,先将锌粉还原后的混合金属用略过量的硝酸溶解,通 过精确调整溶液的pH来进行金属元素逐一分离,已知:
①溶解后的离子浓度如表:
Zn2+ | Cu2+ | Ag+ | |
物质的量浓度(mol/L) | 0.001 | 0.002 | 0.5 |
②某些金属离子的氢氧化物Ksp如表:
Zn2+ | Cu2+ | Ag+ | …… | |
Ksp | 1.0×10-17 | 2.0×10-20 | 2.0×10-8 |
(已知lg2=0.3),该设计方案 ______(填“可行”或“不可行”),其原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种粒子的结构示意图中,说法正确的是
① ②
② ③
③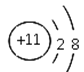 ④
④
A. 它们表示四种不同的元素B. ①④表示的是阳离子
C. ①③④表示的元素都是非金属元素D. ②表示的元素在化合物中通常显+2价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com