
【题目】下列离子方程式书写正确的是
A.金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
B.碳酸钡中加入过量盐酸:CO32-+2H+=CO2↑+H2O
C.偏酸铝钠溶液中加入过量盐酸:AlO2-+4H+=Al3++2H2O
D.铁粉加入到FeCl3溶液中:Fe+Fe3+=2 Fe2+
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2HCHO+NaOH(浓)→HCOONa+CH3OH中,HCHO(甲醛)( )
A.仅被氧化
B.未被氧化,未被还原
C.仅被还原
D.既被氧化,又被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是 ( )
A.氯化铝溶液中加入过量氨水反应的实质:Al3++3NH3·H2O===Al(OH)3↓+3NH![]()
B.在加入铝粉能放出氢气的溶液中,K+、NH![]() 、CO
、CO![]() 、Cl-一定能够大量共存
、Cl-一定能够大量共存
C.镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液
D.依据铝热反应原理,能发生反应2Al+3MgO ![]() 3Mg+Al2O3
3Mg+Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①![]() ,②
,②![]() ,③
,③![]() ,下列说法正确的是
,下列说法正确的是
A. 上述三个反应都有单质生成,所以都是置换反应
B. 氧化性由强到弱顺序为![]()
C. 反应②中还原剂与氧化剂的物质的量之比为6:1
D. ③中![]() 还原剂反应则氧化剂得到电子的物质的量为
还原剂反应则氧化剂得到电子的物质的量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锶(Sr)为第五周期ⅡA族元素,其化合物六水氯化锶(SrCl2·6H2O)是实验室重要的分析试剂,工业上常以天青石(主要成分为SrSO4)为原料制备,生产流程如下:
已知:①经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质;
②SrSO4、BaSO4的溶度积常数分别为3.3×10-7、1.1×10-10;
③SrCl2·6H2O的摩尔质量为267 g/mol。
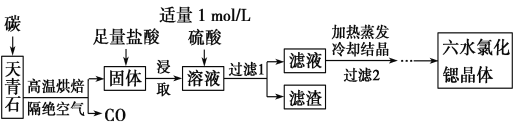
(1) 工业上天青石焙烧前先研磨粉碎,其目的是______________。
(2) 工业上天青石隔绝空气高温焙烧,若0.5 mol SrSO4中只有S被还原,转移了4 mol电子。写出该反应的化学方程式:_________________________。
(3)加入硫酸的目的是____________________________。为了提高原料的利用率,滤液中Sr2+的浓度应不高于___________mol/L(注:此时滤液中Ba2+浓度为1×10-5 mol/L)。
(4)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×10-2mol的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应的离子),待Cl-完全沉淀后,用含Fe3+的溶液作指示剂,用0.200 0 mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_______________________。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为______________(保留4位有效数字)。
(5)工业上常用电解熔融SrCl2制锶单质。由SrCl2·6H2O制取无水氯化锶的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量相等的A、B两种气体,下列说法中错误的是( )
A. 分子数目一定相等
B. 体积一定相等
C. 质量不一定相等
D. 分子中的原子数目可能相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com