
【题目】锶(Sr)为第五周期ⅡA族元素,其化合物六水氯化锶(SrCl2·6H2O)是实验室重要的分析试剂,工业上常以天青石(主要成分为SrSO4)为原料制备,生产流程如下:
已知:①经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质;
②SrSO4、BaSO4的溶度积常数分别为3.3×10-7、1.1×10-10;
③SrCl2·6H2O的摩尔质量为267 g/mol。
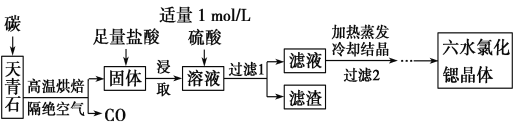
(1) 工业上天青石焙烧前先研磨粉碎,其目的是______________。
(2) 工业上天青石隔绝空气高温焙烧,若0.5 mol SrSO4中只有S被还原,转移了4 mol电子。写出该反应的化学方程式:_________________________。
(3)加入硫酸的目的是____________________________。为了提高原料的利用率,滤液中Sr2+的浓度应不高于___________mol/L(注:此时滤液中Ba2+浓度为1×10-5 mol/L)。
(4)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×10-2mol的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应的离子),待Cl-完全沉淀后,用含Fe3+的溶液作指示剂,用0.200 0 mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_______________________。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为______________(保留4位有效数字)。
(5)工业上常用电解熔融SrCl2制锶单质。由SrCl2·6H2O制取无水氯化锶的方法是 。
【答案】(1)增加反应物的接触面积,提高化学反应速率( 2分)
(2)SrSO4+4C![]() SrS+4CO↑
SrS+4CO↑
(3)除去溶液中Ba2+杂质 0.03
(4)①加1滴NH4SCN溶液溶液由无色变为红色,且30 s内不褪色②93.45%(2分)
(5)加热SrCl2·6H2O失去结晶水(或灼烧等)。(答HCl中0分)(2分)
【解析】
试题分析:(1)天青石焙烧前先研磨粉碎,其目的是为了增加反应物的接触面积,提高化学反应速率,从而提高原料的转化率;
(2)在焙烧的过程中若只有0.5 mol SrSO4中只有S被还原,转移了4 mol电子,则1mol的S转移8mol的电子,由于在反应前元素的化合价为+6价,所以反应后元素的化合价为-2价,因此碳与天青石在高温下发生反应的化学方程式为:SrSO4+4C![]() SrS+4CO↑;
SrS+4CO↑;
(3)在用HCl溶解SrS后的溶液中加入硫酸的目的是除去溶液中Ba2+杂质;由于在Ba2+浓度为1×10-5 mol/L,BaSO4的溶度积常数为1.1×10-10,所以c(SO42-)=![]() mol/L=1.1×10-5mol/L,而SrSO4的溶度积常数为3.3×10-7,所以c(Sr2+)=
mol/L=1.1×10-5mol/L,而SrSO4的溶度积常数为3.3×10-7,所以c(Sr2+)=![]() mol/L=3.0×10-2=0.03mol/L;
mol/L=3.0×10-2=0.03mol/L;
(4)①若NH4SCN不再剩余的Ag+结合形成AgSCN白色沉淀,溶液中就会含有SCN-,就会与Fe3+产生络合物是溶液变为红色,因此滴定达到终点时溶液由无色变为血红色,且30s不褪色;
②n(NH4SCN)=0.2000mol/L×0.02L=4.0×10-3mol,Ag+以AgSCN白色沉淀的形式析出,所以溶液中剩余的Ag+的物质的量为:n(Ag+)=4.0×10-3mol,则与Cl-反应的Ag+的物质的量为:n(Ag+)=1.100×10-2 mol-4.0 × 10-3 mol = 7.0 × 10-3mol,
1.000g产品中SrCl26H2O的物质的量为:n(SrCl26H2O)=n(Ag+)×1/2=3.5×10-3mol,
1.000g产品中SrCl26H2O的质量为:m(SrCl26H2O)=3.5×10-3mol×267 g/mol=0.9345g,
所以产品纯度为:0.9345g÷1g×100%=93.45%;
(5)由SrCl2·6H2O制取无水氯化锶的方法是加热SrCl2·6H2O失去结晶水(或灼烧等)。


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如下图所示:

已知:①SO2(g)+Cl2(g)![]() SO2Cl2(l)△H= -97.3kJmol-1
SO2Cl2(l)△H= -97.3kJmol-1
②硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中易“发烟”;
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
(1)仪器a为恒压分液漏斗,与普通分液漏斗相比,其优点是_____________________。
(2)仪器b的名称为____________,干燥管中碱石灰的主要作用是___________________。
(3)装置E为储气装置,用于提供氯气,则分液漏斗c中盛放的试剂为______________。当装置E中排出氯气1.12L(已折算成标准状况)时,最终得到5.4g纯净的硫酰氯,则硫酰氯的产率为_____。长期存放的硫酰氯会发黄,其原因可能为_________________。
(4)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_________,分离这两种液态产物的方法是_____________。
(5)若将SO2、Cl2按照一定比例通入水中,请设计简单实验验证二者是否恰好完全反应。__________________(简要描述实验步骤、现象和结论)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作完全正确的是
编号 | 实验 | 操作 |
A | 钠与水的反应 | 用镊子从煤油中取出金属钠,切下绿豆大小,放入装满水的烧杯中 |
B | 配制一定浓度的氯化钾溶液 | 准确称取氯化钾固体,放入到 |
C | 闻氯气的方法 | 用手轻轻地在瓶口扇动,使极少量氯气飘进鼻孔 |
D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个烧杯,上层液体继续从分液漏斗下端管口放出 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
B.碳酸钡中加入过量盐酸:CO32-+2H+=CO2↑+H2O
C.偏酸铝钠溶液中加入过量盐酸:AlO2-+4H+=Al3++2H2O
D.铁粉加入到FeCl3溶液中:Fe+Fe3+=2 Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去):![]()
(1)若A为H2S,D的水溶液能使湿润的蓝色石蕊试纸变红,B为刺激性气味气体,写出B→C转化的化学反应方程式:________________________________________。
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使湿润的蓝色石蕊试纸变红:A的化学式为______,实验室制备气体A的化学反应方程式__________________________,A→B转化的化学方程式为_____________________________________________________。
(3)若A为活泼金属元素的单质,D为强碱,焰色反应显黄色,则B是(填化学式)________, C可作为呼吸面具的填充剂,C与二氧化碳发生反应的化学方程式为________________________________,C与水发生反应的离子方程式为___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原子的摩尔质量是Mgmol-1,则一个该原子的真实质量是( )
A.M/6.02×1023 g B.1/M g C.M g D.6.02×1023/M g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应3Cu +8HNO3(稀) == 3Cu(NO3)2 + 2NO↑ +4H2O 中
(1)用单线桥标出电子转移___________________________
(2)还原剂是__________,被还原的元素是__________,还原产物是__________。
(3)若生成2mol的NO气体,溶液中生成的Cu2+为___________mol。
(4)在反应中硝酸显示_________性和____________性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com