
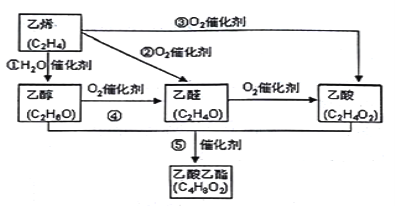
����Ŀ����:��ϩ�����Ǻ���һ������ʯ�ͻ���ˮƽ����Ҫ��־����ͼ������ϩ�ϳ������������ܵĺϳ�·�ߣ�
��ش��������⣺
��1����Ӧ�ܵĻ�ѧ����ʽΪ_____________________________ ��
��2����ʵ�����Ʊ���������ʱ���õ����͵�̼������Һ���������ǣ�___________________��
��3���Ҵ��ĽṹʽΪ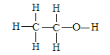 ����ʵ��֤���Ҵ�������һ��������ԭ�ӵķ�Ӧ�Ļ�ѧ����ʽΪ _________________________________��
����ʵ��֤���Ҵ�������һ��������ԭ�ӵķ�Ӧ�Ļ�ѧ����ʽΪ _________________________________��
�������к������ᣬ�����ڳ��³�ѹ����һ����ɫ��ճ�Ⱥܴ��Һ�塣ȡ9.0g������������Na��Ӧ���ڱ�״���¿��ռ���2.24L���壻��ȡ9.0g������������NaHCO3��Һ��Ӧ�����ɵ�CO2�����ڱ�״�������Ϊ2.24L����֪��������к���һ��������ش��������⣺
��1���������Է�������Ϊ��_______________________��
��2����Ũ������ڵ������£��������������Ӧ���ɻ�״��������д���÷�Ӧ�Ļ�ѧ��Ӧ����ʽ��________________________���䷴Ӧ����Ϊ��_______________��
���𰸡�2CH3CH2OH + O2![]() 2CH3CHO + 2H2O���ջӷ�������������Ҵ������������������ܽ��2CH3CH2OH + 2Na �� 2CH3CH2ONa + H2��902CH3CH��OH��COOH
2CH3CHO + 2H2O���ջӷ�������������Ҵ������������������ܽ��2CH3CH2OH + 2Na �� 2CH3CH2ONa + H2��902CH3CH��OH��COOH![]()
 +2H2Oȡ����Ӧ��������Ӧ
+2H2Oȡ����Ӧ��������Ӧ
��������
����ͼ��֪����ϩ��ˮ�����ӳɷ�Ӧ�����Ҵ����Ҵ�����������ȩ����ȩ�����������ᣬ����ϩ������������ȩ����ϩ�������������ᣬ�Ҵ������ᷢ��������Ӧ��������������
��1����Ӧ��Ϊ�Ҵ�������������ȩ����ѧ����ʽΪ2CH3CH2OH + O2![]() 2CH3CHO + 2H2O���ʴ�Ϊ��2CH3CH2OH + O2
2CH3CHO + 2H2O���ʴ�Ϊ��2CH3CH2OH + O2![]() 2CH3CHO + 2H2O��
2CH3CHO + 2H2O��
��2����ʵ�����Ʊ���������ʱ�����͵�̼������Һ�������ջӷ�������������Ҵ������������������ܽ�ȣ��ʴ�Ϊ�����ջӷ�������������Ҵ������������������ܽ�ȣ�
��3���Ҵ��ĽṹʽΪ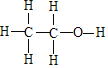 ����ͬ���칹��ĽṹʽΪ
����ͬ���칹��ĽṹʽΪ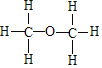 ������ͨ��������Ƶķ�Ӧ֤���Ҵ�������һ��������ԭ�ӣ���Ӧ�Ļ�ѧ����ʽΪ2CH3CH2OH+2Na��2CH3CH2ONa+H2�����ʴ�Ϊ��2CH3CH2OH+2Na��2CH3CH2ONa+H2����
������ͨ��������Ƶķ�Ӧ֤���Ҵ�������һ��������ԭ�ӣ���Ӧ�Ļ�ѧ����ʽΪ2CH3CH2OH+2Na��2CH3CH2ONa+H2�����ʴ�Ϊ��2CH3CH2OH+2Na��2CH3CH2ONa+H2����
������1��9.0g����������Ľ����Ʒ�Ӧ��������ɵ��������Ϊ2.24L����������ѻ���Ϊ��״���������������������к��й������Ǵ��ǻ����Ȼ����������������ʵ���Ϊ![]() =0.1mol�������2-OH��-COOH����H2��֪��9.0g���Ậ�������ǻ������Ȼ���0.2mol�����ǻ����Ȼ���0.1mol����ȡ9.0g����������ı���NaHCO3��Һ��Ӧ��˵����������л������Ȼ������ɶ�����̼�����ʵ���Ϊ0.1mol������-COOH��CO2��֪��9.0g���Ậ0.1mol-COOH������9.0g�����л�����0.1mol-OH����90g��������к�1mol-OH��1mol-COOH����֪��������л���һ��-CH3����90-17-45-15=13����������ӳ���-OH��-COOH��-CH3�⣬����-CH�ṹ������Ľṹ��ʽΪCH3CH��OH��COOH���������Է�������Ϊ��12��3+1��6+16��3=90���ʴ�Ϊ��90��
=0.1mol�������2-OH��-COOH����H2��֪��9.0g���Ậ�������ǻ������Ȼ���0.2mol�����ǻ����Ȼ���0.1mol����ȡ9.0g����������ı���NaHCO3��Һ��Ӧ��˵����������л������Ȼ������ɶ�����̼�����ʵ���Ϊ0.1mol������-COOH��CO2��֪��9.0g���Ậ0.1mol-COOH������9.0g�����л�����0.1mol-OH����90g��������к�1mol-OH��1mol-COOH����֪��������л���һ��-CH3����90-17-45-15=13����������ӳ���-OH��-COOH��-CH3�⣬����-CH�ṹ������Ľṹ��ʽΪCH3CH��OH��COOH���������Է�������Ϊ��12��3+1��6+16��3=90���ʴ�Ϊ��90��
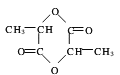
��2������Ľṹ��ʽΪCH3CH��OH��COOH��2�����������һ�������¿ɷ���������Ӧ������Ԫ��״�������Ӧ����ʽΪ��2CH3CH��OH��COOH![]()
 +2H2O���ʴ�Ϊ��2CH3CH��OH��COOH
+2H2O���ʴ�Ϊ��2CH3CH��OH��COOH![]()
 +2H2O��������Ӧ����ȡ����Ӧ����
+2H2O��������Ӧ����ȡ����Ӧ����


 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У���ӦX2��g��+Y2��g��2XY��g������H��0���ﵽ��ƽ�⣮�ڽ��ı�ijһ�����ﵽ��ƽ�⣬ͼ�жԴ˹��̵ķ�����ȷ����

A. ͼI�Ǽ����ʵ������ı仯���
B. ͼ����������������ı仯���
C. ͼ��������ѹǿ�ı仯���
D. ͼ���������¶ȵı仯���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����£�������Һ�и�Ũ�ȹ�ϵ����ȷ����
A. ������������ʵ���Ũ�ȵ�NaX������HX��Ϻ����ҺpH��������һ���У�c(Na+)��c(HX)��c(X-)��c(H+)��c(OH-)
B. 1L0.1molL-1CuSO4��(NH4)2SO46H2O����Һ�У�c(SO42-)��c(NH4+)��c(Cu2+)��c(H+)��c(OH-)
C. 0.1molL-1NaHCO3��Һ�У�c(Na+)+c(H+)+c��H2CO3����c(HCO3-)+c(CO32-)+c(OH-)
D. ���ʵ���Ũ�ȷֱ�Ϊc1��c2�����ִ�����Һ������pH�ֱ�Ϊa��a+1����c1��10c2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ���һ���֣�����A��C��D��EΪ������Ԫ�أ�����������֮��Ϊ23������˵����ȷ����

A. Ԫ��A��Ӧ���⻯�������һ������̬
B. Ԫ��B��E��ԭ���������19
C. ������Ƶķ�Ӧ�У�1molCԭ�Ӻ�1molEԭ�ӵõ�����Ŀһ�����
D. A��C��D�����γ�18e-����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������Ԫ�أ����ܻ�������Ϊ���ϣ������ƾõ���ʷ���ڻ�е���졢���Բ��ϵ�����Ҳ���й㷺��Ӧ�ã���ش���������:
��1��Co��̬ԭ�ӵĵ����Ų�ʽΪ__________________________��
��2��̪ݼ�ܽ������ڹ����ϡ������Թ�ѧ���ϡ����ѧ�еĹ������������ȷ���õ��㷺��Ӧ�ã���ṹ��ͼ��ʾ����������Ϊ�����ӡ�
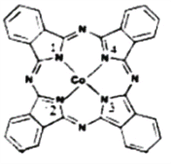
��̪ݼ�������ַǽ���ԭ�ӵĵ縺���д�С��˳��Ϊ____________��(����Ӧ��Ԫ�ط�������)��̼ԭ�ӵ��ӻ��������Ϊ___________________________��
����������ͨ����λ����ϵĵ�ԭ�ӵı����___________________________��
��3����KCN������Co2+������Һ���к�ɫ��Co(CN)2�������������ڹ�����KCN��Һ��������ɫ��[Co(CN)6]4-�����������е���λ��Ϊ________����λԭ��Ϊ____________________��
��4��Co��һ��������ľ�����ͼ��ʾ���ڸþ�������һ����ԭ�ӵȾ������������ԭ����_____������һ����ԭ�ӵȾ����Ҵν�����ԭ����______���������ܵ������ᄃ������ԭ�����������ڵ���ԭ��֮��ľ���Ϊr������ԭ��������ν��ڵ���ԭ��֮��ľ���Ϊ______����֪�ڸ��ܵ������ᄃ������ԭ�ӵİ뾶Ϊapm����ԭ�ӵİ뾶Ϊbpm�������ھ������ǽ��ܽӴ��ģ����ڸ��ܵ������ᄃ����ԭ�ӵĿռ�������Ϊ____(�ú�a��b��ʽ�ӱ�ʾ)��
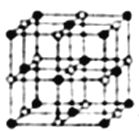
��5���������Ͽ�ѧ����ʵ����һ������С�鷢������5K�³��ֳ����Եľ��壬�þ������CoO2�IJ�״�ṹ(����ͼ��ʾ��С���ʾCoԭ�ӣ������ʾOԭ��)�������ô��������ظ��ṹ��Ԫʾ��ͼ��������CoO2�Ļ�ѧ��ɵ���_______��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������м�������ˮ�����ܷ����ų������Ļ�ѧ��Ӧ���У� ��
A.��B.��������C.������D.̼������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������;��������ʵ�˵���У�����ȷ������
A. ����ϩ��������ʳƷ��
B. ͨ�Ų�ҵ���þ�������������ά
C. ����������̼��þ��С�մ�ȿ���������θ�����
D. Һ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ʵ��������ʯ�͵�ʵ��װ�ã�ʵ����Ҫ�ռ�60��150���150��300�����֡���ش��������⣺
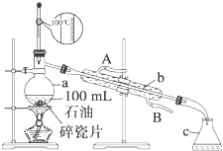
��1������a�Ĺ�������_______������b��c�����ƣ�b_______��c_______��
��2��ʵ����ѡ�¶ȼ��Ǵ���ģ���ȷ��ѡ��Ӧ����_______��
��3��ʵ��ʱ������a�м������������Ƭ����Ŀ����_______��
��4��ʵ��ʱ������b��ͨ����ȴˮ����ָ����ȴˮ������_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ1��ijͬѧ��ʵ�����н������ȷ�Ӧ(������)��ʵ��װ�ã�ʵ�������۲쵽������֮һΪ��ֽ©�����²����մ���������������ɳ������

��1��д���÷�Ӧ�Ļ�ѧ����ʽ��________________________________________________��
��2��Ϊ�������ȷ�Ӧ��Ĺ���ɷ֣�����д�±���
����ɷ� | �������� | ʵ����������� |
�� | ____________ | ___________ |
������ | _____________ | ____________ |
��3��̽�����ȷ�Ӧ���������ʣ�����Ӧ�������еĹ�����������ձ��У�����һ����ϡ���ᣬ������ȫ�ܽ⣬��Ӧ������������ų�(���ý����ɰ�ϡHNO3)��ԭΪNH4NO3)���ڷ�Ӧ�����Һ�л����μ�4 mol��L��1��NaOH��Һ���������������ʵ���(mol)�����NaOH��Һ�����(ml)�Ĺ�ϵ��ͼ2��ʾ��
��1д��DE�η�����Ӧ�����ӷ���ʽ��_____________________________________________��
��B��A�IJ�ֵΪ_______________________________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com