
【题目】下表为元素周期表的一部分,其中A、C、D、E为短周期元素,最外层电子数之和为23,下列说法正确的是

A. 元素A对应的氢化物,常温下一定是气态
B. 元素B、E的原子序数相差19
C. 与金属钠的反应中,1molC原子和1molE原子得电子数目一定相等
D. A、C、D均可形成18e-分子
【答案】D
【解析】根据周期表的结构,已知A、C、D、E为短周期元素,设C的最外层电子数为x,则这四种元素最外层电子数之和为(x-2)+x+(x+1)+x=23,x=6,所以它们分别为C、O、F、S,则B为As。A、碳对应的氢化物即烃类,常温下有气体,也有液体和固体,所以A错误;B、As的原子序数为33,S的原子序数为16,二者相差17,故B错误;C、与金属钠反应时,1mol氧原子可以得到1mole-生成Na2O2,也可能得到2 mole-生成Na2O,而1mol硫原子只能得到2 mole-生成Na2S,故C错误;D、碳、氧、氟可形成C2H6、H2O2和F2的18e-分子,故D正确。本题正确答案为D。


科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.钠和水反应Na+H2O=Na++OH-+H2↑
B.碳酸钙与稀盐酸反应:2H++CO32-=CO2↑+H2O
C.氯气溶于水的离子方程式为Cl2+H2O2H++Cl-+ClO-
D.碳酸氢钠溶液中加入醋酸:HCO3-+CH3COOH=CH3COO-+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是:
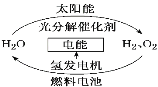
A. H2O的分解反应是放热反应
B. 氢能源已被普遍使用
C. 2 mol液态H2O具有的总能量低于2 mol H2和1 mol O2的能量
D. 氢氧燃料电池放电过程中是将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质结构和性质的说法不正确的是
A. 分子式为C5H10且与乙烯互为同系物的结构共有5种
B. 可用燃烧法鉴别环乙烷、苯、CCl4
C. 分子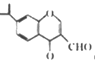 中所有碳原子不可能位于同一平面
中所有碳原子不可能位于同一平面
D. 三联苯![]() 与四联苯
与四联苯![]() 互为同系物
互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是

A. 该制氢工艺中光能最终转化为化学能
B. 该装置工作时,H+由b极区流向a极区
C. a极上发生的电极反应为Fe3++e-=Fe2+
D. a极区需不断补充含Fe3+和Fe2+的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以食盐为原料进行生产并综合利用的某些过程如图。
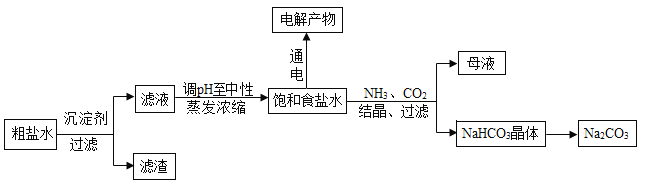
(1) 除去粗盐中的微溶物质CaSO4通常用Na2CO3处理,请用平衡移动原理解释说明:_____________。
(2) 人们习惯上把电解饱和食盐水的工业叫做氯碱工业.图1表示电解饱和NaCl 溶液的装置,X、Y是石墨棒。实验开始后,检验Y 电极反应产物的方法是_________________。
(3) 若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是__________。
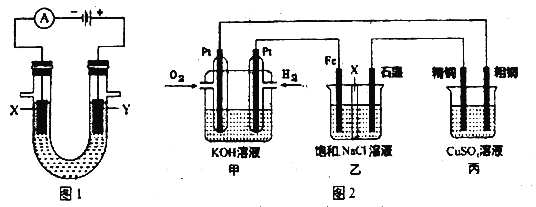
(4) 某同学设计一个燃料电池(如图2所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X 为阳离子交换膜。根据要求回答相关问题:
①通入氢气电极的反应式为__________________。
②反应一段时间后,在乙装置中滴入酚酞溶液,______________(填“铁”或“石墨”)极区的溶液先变红。
③如果粗铜中含有锌、银等杂质,丙装置中反应一段时间后,硫酸铜溶液浓度将___________(填“增大”“减小”或“不变”)。
④若在标准状况下有224mL氧气参加反应,则乙装置中铁电极上生成的气体在标况下体积为_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:乙烯产量是衡量一个国家石油化工水平的主要标志。下图是由乙烯合成乙酸乙酯可能的合成路线:
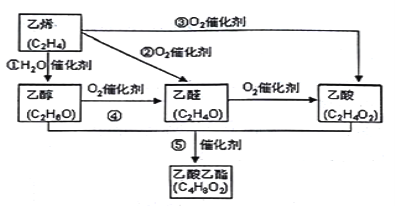
请回答下列问题:
(1)反应④的化学方程式为_____________________________ ;
(2)在实验室制备乙酸乙酯时,用到饱和的碳酸钠溶液,其作用是:___________________;
(3)乙醇的结构式为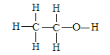 ,若实验证明乙醇分子有一个特殊氢原子的反应的化学方程式为 _________________________________;
,若实验证明乙醇分子有一个特殊氢原子的反应的化学方程式为 _________________________________;
Ⅱ:酸奶中含有乳酸,乳酸在常温常压下是一种无色的粘度很大的液体。取9.0g乳酸与足量的Na反应,在标准状况下可收集到2.24L气体;另取9.0g乳酸与足量的NaHCO3溶液反应,生成的CO2气体在标准状况下体积为2.24L。已知乳酸分子中含有一个甲基,请回答下列问题:
(1)乳酸的相对分子质量为:_______________________;
(2)在浓硫酸存在的条件下,两分子乳酸相互反应生成环状酯类化合物,请写出该反应的化学反应方程式:________________________,其反应类型为:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法正确的是
A. 1mol 的P4O6中含有6 NA个P—O键
B. 0.1mo1H2和0.1molI2于密闭容器中充分反应后,分子总数小于0.2 NA
C. pH=3的CH3COOH溶液中,含有10-3NA个H+
D. 高温下,16.8gFe 与足量的水蒸气反应,失去0.8NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知白磷和P4O6的分子结构如图所示,又知化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量,现查知P—P键能为198 kJ·mol-1、P—O键能为360 kJ·mol-1、O===O键能为498 kJ·mol-1。若生成1 mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为( )
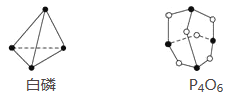
A. 吸收1 638 kJ能量 B. 放出1 638 kJ能量
C. 吸收126 kJ能量 D. 放出126 kJ能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com