
【题目】阿伏加德罗常数的值为NA,下列说法正确的是
A. 1mol 的P4O6中含有6 NA个P—O键
B. 0.1mo1H2和0.1molI2于密闭容器中充分反应后,分子总数小于0.2 NA
C. pH=3的CH3COOH溶液中,含有10-3NA个H+
D. 高温下,16.8gFe 与足量的水蒸气反应,失去0.8NA个电子
科目:高中化学 来源: 题型:
【题目】有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,制造出新型燃料电池,装置如图所示,下列有关说法正确的是

A. 通入N2的一极为负极
B. 通入H2的电极反应为:H2+2e-=2H+
C. 物质A是NH4Cl
D. 反应过程中左边区域溶液pH逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,其中A、C、D、E为短周期元素,最外层电子数之和为23,下列说法正确的是

A. 元素A对应的氢化物,常温下一定是气态
B. 元素B、E的原子序数相差19
C. 与金属钠的反应中,1molC原子和1molE原子得电子数目一定相等
D. A、C、D均可形成18e-分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途或相关性质的说法中,不正确的是:
A. 聚乙烯可用于制食品袋
B. 通信产业中用晶体硅来生产光导纤维
C. 氢氧化铝、碳酸镁、小苏打等可用于治疗胃酸过多
D. 液氨可用作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。20℃时,有一组H2C2O4和NaOH的混合溶液,其中c (H2C2O4) +c (HC2O4)+c (C2O42-)=0.1mol/L,溶液中部分微粒的物质的量浓度随pH 的变化如图所示。[电离度=( 已电离电解质分子数/原弱电解质分子数) x 100%] 下列说法不正确的是
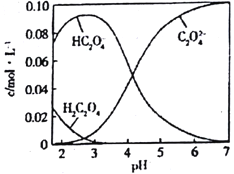
A. H2C2O4的Ka2数量级为10-5
B. 在NaHC2O4溶液中,c (Na+)>c(HC2O4)>c (H+)>c(C2O42-)>c (OH-)
C. 0.1mol/L 的H2C2O4溶液,H2C2O4的电离度约为80%
D. pH=7.0的溶液中,c (Na+)=0.1+c(C2O42-)-c (H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是实验室蒸馏石油的实验装置,实验需要收集60~150℃和150~300℃的馏分。请回答下列问题:
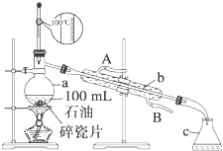
(1)仪器a的规格和名称_______,仪器b、c的名称:b_______,c_______。
(2)实验所选温度计是错误的,正确的选择应该是_______。
(3)实验时在仪器a中加入了少量碎瓷片,其目的是_______。
(4)实验时在仪器b中通入冷却水,请指明冷却水的流向_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷、氧气、KOH 溶液可构成燃料电池提供电能。按要求填写:
(1)该电池总反应的离子方程式为___________________________。
(2)通入甲烷的电极为原电池的________极,该电极反应式为:______________________。
(3)电池工作时,正极区域溶液的pH__________(填“增大、减小或不变”)。
(4) 电路中通过3mol 电子转移时,消耗的氧气体积为(标况)_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校环保兴趣小组在处理污水样品时,需将质量分数为37%的浓盐酸(密度为1.19gcm﹣3)配制成250mL0.1molL﹣1的盐酸溶液。
(1)在如图所示仪器中,配制上述溶液不需要的是______(填图中相应仪器的字母)。除图中已有仪器外,配制上述溶液还需要的玻璃仪器是_______,其作用按使用的先后顺序分别是_______和_______。

(2)根据计算,下列量程或规格中,本实验量筒应使用的是______;容量瓶应使用______(填写相应的序号)。
A.10mL B.100mL C.250mL D.500mL
(3)在量取浓盐酸后,下列操作的先后顺序是______(用编号表示)。
①待稀释的盐酸温度与室温一致后,沿玻璃棒注入所选定规格的容量瓶中
②往容量瓶中小心加蒸馏水至液面接近环形刻度线1cm~2cm处,改用胶头滴管加蒸馏水,使凹液面最低处与瓶颈的环形刻度线相切
③在盛盐酸的烧杯中注入适量蒸馏水,并用玻璃棒搅拌,使其混合均匀
④用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部注入容量瓶
(4)关于容量瓶的使用,下列操作正确的是______(填字母,下同)。
A.使用容量瓶前检查它是否漏水
B.容量瓶用水洗净后,再用配好的稀HCl溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1cm~2cm处,改用胶头滴管加蒸馏水至刻度线
D.配制溶液时,若试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加水至接近刻度线1cm~2cm处,改用胶头滴管加蒸馏水至刻度线
E。盖好瓶盖,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
(5)若定容后摇匀静置,发现凹液面低于线,此时应该______。
A.直接转移到细口试剂瓶中
B.再用胶头滴管加水,重新定容
C.将此溶液倒掉,重新配制
D.直接储存于容量瓶中
(6)假设配制时其他操作均正确,只出现以下某一情况,试判断所配制的溶液浓度相比于要求的值(即0.1molL﹣1)如何变化。(a.偏高;b.偏低;c.无影响,在下列横线上填相应的字母)。
①容量瓶中有少量蒸馏水______。
②烧杯和玻璃棒没有洗涤2~3次______。
③配制的溶液装入洁净的但有少量蒸馏水的试剂瓶中______。
④若定容时俯视,所配溶液的物质的量浓度______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com