
【题目】关于化工生产原理的叙述中,不符合目前工业生产实际的是
A.硫酸工业中,三氧化硫在吸收塔内被水吸收制成浓硫酸
B.炼铁工业中,用焦炭和空气反应产生的一氧化碳在高温下还原铁矿石中的铁
C.合成氨工业中,用铁触媒作催化剂,可提高单位时间氨的产量
D.氯碱工业中,电解槽的阴极区产生NaOH
【答案】A
【解析】
A.吸收塔中SO3如果用水吸收,发生反应:SO3+H2O═H2SO4,该反应为放热反应,放出的热量易导致酸雾形成,阻隔在三氧化硫和水之间,阻碍水对三氧化硫的吸收;而浓硫酸的沸点高,难以气化,不会形成酸雾,同时三氧化硫易溶于浓硫酸,所以工业上从吸收塔顶部喷洒浓硫酸作吸收液,最终得到“发烟”硫酸,A项错误;
B、工业制铁是CO还原铁矿石:3CO+Fe2O3![]() 2Fe+3CO2,B项正确;
2Fe+3CO2,B项正确;
C.催化剂不会引起化学平衡的移动,但是加快了化学反应速率,从而提高单位时间氨的产量,C项正确;
D.氯碱工业中,阴极是氢离子得到电子生成氢气发生还原反应,阴极附近水电离平衡破坏,同时生成NaOH,D项正确;
答案选A。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】将一铁、铜混合物粉末平均分成三等份,分别加入到同浓度、不同体积的稀硝酸中,充分反应后,收集到NO气体的体积及剩余固体的质量如表 (设反应前后溶液的体积不变,气体体积已换算为标准状况时的体积):
实验序号 | 稀硝酸的体积/mL | 剩余固体的质量/g | NO的体积/L |
1 | 100 | 17.2 | 2.24 |
2 | 200 | 8.00 | 4.48 |
3 | 400 | 0 | V |
下列说法正确的是( )
A. 表中V=7.84 L
B. 原混合物粉末的质量为25.6 g
C. 原混合物粉未中铁和铜的物质的量之比为2:3
D. 实验3所得溶液中硝酸的物质的量浓度为0.875 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是______。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.单质的熔点降低
d.氧化物对应的水化物碱性减弱,酸性增强
原子最外层电子数与次外层电子数相同的元素名称为_____,氧化性最弱的简单阳离子是____。
(2)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是_____;制铝时,电解Al2O3而不电解AlCl3的原因是_____。
(3)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)![]() SiCl4
SiCl4![]() SiCl4(纯)
SiCl4(纯)![]() Si(纯)
Si(纯)
写出SiCl4的电子式:_____;
(4)下列气体不能用浓硫酸干燥,可用P2O5干燥的是_____。
a.NH3 b.HI c.SO2 d.CO2
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机物可根据其组成和性质进行分类。现有Cl2、Na、CO2、Na2O、Na2O2、NH3六种物质,完成下列填空:
(1)由分子构成的单质是____________,属于极性分子的是____________。
(2)既有离子键又有共价键的物质的电子式为____________。
(3)上述化合物中组成元素的原子半径由大到小的顺序是____________。
(4)根据与水反应的不同,上述物质可分成A组(CO2、Na2O和NH3)和B组(Cl2、Na和Na2O2),分组的依据是________________________。
(5)在酸性高锰酸钾溶液中加入Na2O2,溶液褪色,发生反应![]() (未配平),配平该反应的离子方程式并标出电子转移方向与数目。____________
(未配平),配平该反应的离子方程式并标出电子转移方向与数目。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一个碳原子上连有两个羟基时,易发生下列转化:![]() 。请根据如图回答:
。请根据如图回答:
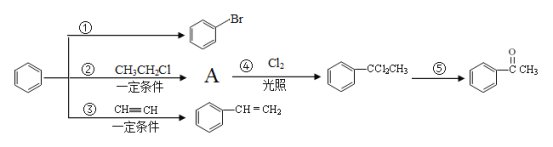
(1)物质A的化学式为C8H10,写出A的名称___,鉴别A和![]() 可选用的试剂是___。
可选用的试剂是___。
(2)写出反应①的化学反应方程式____。
(3)反应①~⑤中,属于加成反应的是____;反应⑤的反应条件为___。
(4)写出2种满足下列条件的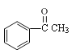 同分异构体的结构简式。___,____。
同分异构体的结构简式。___,____。
①含苯环结构 ②能发生银镜反应
(5)设计由![]() 制备
制备 ![]() 的合成路线(无机试剂任选)。_____
的合成路线(无机试剂任选)。_____
合成路线常用的表示方式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝广泛应用于航空、建筑、汽车等行业,目前工业上采用电解氧化铝和冰晶石(Na3AlF6)混合物的方法制取铝。回答下列问题:
(1)某同学写出了铝原子的4种不同状态的电子排布图
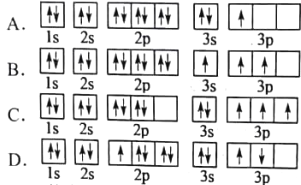
其中能量最低的是___________(填字母),电子由状态C到状态B所得原子光谱为___________光谱(填“发射”或“吸收”),状态D是铝的某种激发态,但该电子排布图有错误,主要是不符合____________________________________________。
(2)熔融状态的氯化铝可挥发出二聚分子Al2Cl6,其结构如图所示。
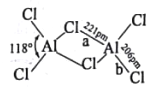
①a键的键能_________b键的键能(填“>”“<”或“=”),其理由是______________________。
②Al2Cl6中铝原子的杂化方式为___________;AlCl3的空间结构为 ___________________。
(3)冰晶石属于离子化合物,由Na+和AIF63-组成,在冰晶石的晶胞中,AlF63-占据的位置相当于氯化钠晶胞中Cl-的位置。
①冰晶石的化学式为___________,一个冰晶石晶胞中Na+的个数为___________。
②已知冰晶石的密度为2.95g/cm3,则冰品石晶胞的边长a=___________pm(列出算式即可,阿伏加德罗常数值为6.02×1023)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知三种有机物 ![]() (x)
(x) ![]() (y)
(y)![]() (z),下列说法不正确的是
(z),下列说法不正确的是
A.x、y、z 互为同分异构体,z 的二氯代物有三种
B.x、y 的一氯代物均只有三种,z 的一氯代物有一种
C.x、y 可使溴的四氯化碳溶液因发生加成反应而褪色
D.x、y、z 中只有 x 的所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验:
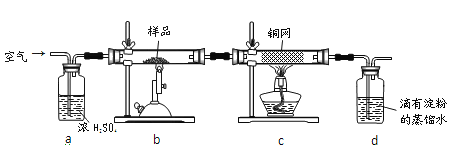
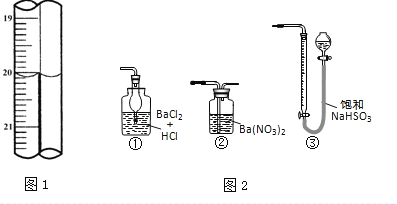
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,末读数如图1所示。完成下列填空:
(1)称量样品所用的仪器为___,将样品研细后再反应,其目的是__________。
(2)装置a的作用是___________。上述反应结束后,仍需通一段时间的空气,其目的是___。
(3)滴定时,标准碘溶液所耗体积为___mL。判断滴定已达终点的现象是_____________。
(4)通过计算可知,该黄铜矿的纯度为_________。
(5)若用图2装置替代上述实验装置d,同样可以达到实验目的的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积一定的密闭容器中加入等物质的量的X、Y,进行如下可逆反应:X(g)+Y(g)![]() Z(g)+W(s) ΔH>0,下列叙述正确的是
Z(g)+W(s) ΔH>0,下列叙述正确的是
A. 平衡后若继续充入X,平衡正向移动,Y的转化率增大
B. 平衡后若升高体系温度,平衡逆向移动,Z的体积分数减小
C. 平衡后若移走部分W,平衡正向移动
D. 平衡后若移走部分X,上述反应的ΔH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com