
【题目】体积一定的密闭容器中加入等物质的量的X、Y,进行如下可逆反应:X(g)+Y(g)![]() Z(g)+W(s) ΔH>0,下列叙述正确的是
Z(g)+W(s) ΔH>0,下列叙述正确的是
A. 平衡后若继续充入X,平衡正向移动,Y的转化率增大
B. 平衡后若升高体系温度,平衡逆向移动,Z的体积分数减小
C. 平衡后若移走部分W,平衡正向移动
D. 平衡后若移走部分X,上述反应的ΔH减小
科目:高中化学 来源: 题型:
【题目】关于化工生产原理的叙述中,不符合目前工业生产实际的是
A.硫酸工业中,三氧化硫在吸收塔内被水吸收制成浓硫酸
B.炼铁工业中,用焦炭和空气反应产生的一氧化碳在高温下还原铁矿石中的铁
C.合成氨工业中,用铁触媒作催化剂,可提高单位时间氨的产量
D.氯碱工业中,电解槽的阴极区产生NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是无色具有水果香味的液体,沸点为 77.2 ℃,实验室某次制取乙酸乙酯用冰醋酸、乙醇、浓硫酸、饱和碳酸钠溶液以及极易与乙醇结合的氯化钙溶液。主要装置如下图所示:
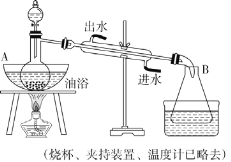
实验步骤:
①先向 A 中的蒸馏烧瓶中注入少量乙醇和浓硫酸后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗里待用。
②加热油浴保温。
③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,
调节加入速率,使蒸出酯的速率与进料速率大体相等,直到加料完成。
④保持油浴温度一段时间,至不再有液体馏出后,停止加热。
⑤取下 B 中的锥形瓶,将一定量饱和 Na2CO3 溶液分批少量多次地加到馏出液里,边加边振荡,至无气泡产生为止。
⑥将⑤的液体混合物用分液漏斗分液,弃去水层。
⑦将饱和 CaCl2 溶液(适量)加入分液漏斗中,振荡一段时间后静置,放出水层(废液)。
⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品。
(1)实验中浓硫酸的主要作用是_____。
(2)用饱和 Na2CO3 溶液洗涤粗酯的目的是_____。用饱和 CaCl2溶液洗涤粗酯的目的是_____。
(3)在步骤⑧所得的粗酯里还含有的杂质是_____。
(4)写出本实验制取乙酸乙酯的化学方程式:_____。
(5)若用 46g 乙醇与 30g 醋酸反应,如果实际产率是理论产率的 65%,试计算可得到的乙酸乙酯的质量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数,下列说法正确的是( )
A.6.2g白磷分子(P4)中含P-P键数为0.05NA
B.1mol CH3+含电子数为8NA
C.标准状况下,22.4LSO3中含原子数为4NA
D.常温常压下,11.2LCO2气体通过足量Na2O2充分反应,转移电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)![]() 3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算:
3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算:
(1)5min末A的物质的量浓度为________。
(2)前5min内用B表示的化学反应速率v(B)为________。
(3)化学方程式中n值为________。
(4)此反应在四种不同情况下的反应速率分别为:
①v(A)=5mol/(L·min)
②v(B)=6mol/(L·min)
③v(C)=4.5mol/(L·min)
④v(D)=8mol/(L·min)
其中反应速率最快的是________(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液态化合物AB会发生微弱的自身电离,电离方程式为AB![]() A++B-,在不同温度下其平衡常数为K(25 ℃)=1.0×10-14,K(35 ℃)=2.1×10-14。则下列叙述正确的是 ( )。
A++B-,在不同温度下其平衡常数为K(25 ℃)=1.0×10-14,K(35 ℃)=2.1×10-14。则下列叙述正确的是 ( )。
A.c(A+)随温度升高而降低
B.在35 ℃时,c(A+)>c(B-)
C.AB的电离程度(25 ℃)>(35 ℃)
D.AB的电离是吸热过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲配制0.5 mol·L-1的NaOH溶液500 mL,有以下仪器:
①烧杯②药匙③1000 mL容量瓶④500 mL容量瓶⑤玻璃棒⑥托盘天平(带砝码)。
(1)配制时,必须使用的仪器有_____(填代号),还缺少的仪器是_____,该实验中两次用到玻璃棒,其作用分别是_____,_____。
(2)使用容量瓶前必须进行的一步操作是_____。
(3)配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤⑦定容 ⑧装瓶,其正确的操作顺序是________。
(4)配制一定物质的量浓度的溶液,造成浓度偏高的操作是_____
A.定容时,滴加蒸馏水超过刻度线 B.定容时,眼睛俯视刻度线
C.洗涤烧杯和玻璃棒的溶液未转入容量瓶中 D.定容时,眼睛仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示的转化关系以及现象回答下列问题。
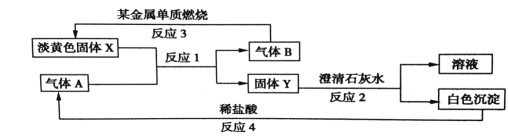
(1)固体 X的化学式是:________________
(2)写出反应1 的化学方程式:____________________________
(3)写出反应2 的离子方程式:________________________________
(4)若15.6gX 和足量的气体 A反应,转移__________mol 电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物YX2、ZX2中,X、Y、Z的核电荷数小于18;X原子最外能层的p能级中有一个轨道充填了2个电子,Y原子的最外层中p能级的电子数等于前一能层电子总数,且X和Y具有相同的电子层数;Z与X在周期表中位于同一主族。回答下列问题:
(1)X的电子排布式为______________,Y的轨道表示式为_________________;
(2)YX2的电子式是______________,分子构型为_________,中心原子发生了____杂化。
(3)Y与Z形成的化合物的分子式是_______,该化合物中化学键是________键(填“极性”或“非极性”),该分子属于__________分子(填“极性”或“非极性”)。
(4)Y的氢化物中分子构型为正四面体的是_______(填名称),键角为_______,中心原子的杂化形式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com