
【题目】设NA为阿伏伽德罗常数,下列说法正确的是( )
A.6.2g白磷分子(P4)中含P-P键数为0.05NA
B.1mol CH3+含电子数为8NA
C.标准状况下,22.4LSO3中含原子数为4NA
D.常温常压下,11.2LCO2气体通过足量Na2O2充分反应,转移电子数为2NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】无机物可根据其组成和性质进行分类。现有Cl2、Na、CO2、Na2O、Na2O2、NH3六种物质,完成下列填空:
(1)由分子构成的单质是____________,属于极性分子的是____________。
(2)既有离子键又有共价键的物质的电子式为____________。
(3)上述化合物中组成元素的原子半径由大到小的顺序是____________。
(4)根据与水反应的不同,上述物质可分成A组(CO2、Na2O和NH3)和B组(Cl2、Na和Na2O2),分组的依据是________________________。
(5)在酸性高锰酸钾溶液中加入Na2O2,溶液褪色,发生反应![]() (未配平),配平该反应的离子方程式并标出电子转移方向与数目。____________
(未配平),配平该反应的离子方程式并标出电子转移方向与数目。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验:
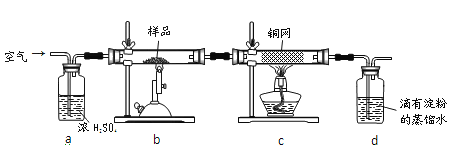
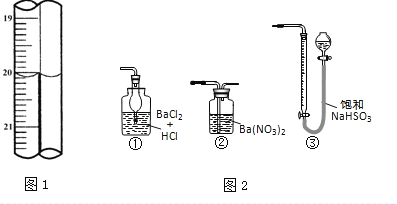
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,末读数如图1所示。完成下列填空:
(1)称量样品所用的仪器为___,将样品研细后再反应,其目的是__________。
(2)装置a的作用是___________。上述反应结束后,仍需通一段时间的空气,其目的是___。
(3)滴定时,标准碘溶液所耗体积为___mL。判断滴定已达终点的现象是_____________。
(4)通过计算可知,该黄铜矿的纯度为_________。
(5)若用图2装置替代上述实验装置d,同样可以达到实验目的的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中 A、B、C、D 分别是三种烃的分子结构,请回答下列问题:
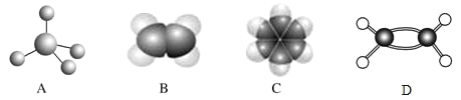
(1)上图中 D 是有机物分子的_____模型;
(2)烃 A 及其同系物的分子式符合通式_____(碳原子个数用 n 表示),当 n=6 时的同分异构体数目为_____(填数字)种;
(3)上述三种有机物烃中,所有原子均共平面的是_________(填有机物的名称);
(4)下列关于烃 C 的叙述正确的是_____(填序号)。
A.分子式为 C6H6,它不能使酸性 KMnO4 溶液褪色,属于饱和烃
B.从分子结构看,C 分子中含有碳碳双键,属于烯烃
C.烃 C 的同系物二甲苯(C8H10)有三种不同的结构,均属于芳香烃
D.烃 C 中加入溴水,充分振荡,静置,下层无色
(5)分别写出 B 使溴水褪色、C 的溴代反应的化学方程式____________、_____________,并指明反应类型:________________、______________
(6)C 的同系物甲苯与足量氢气加成后的产物(甲基环己烷)的一氯代物有_____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 lmol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO2(g) △H=+393.5kJ/mol
B.C(s)+![]() O2(g)=CO(g) △H=﹣393.5kJ/mol
O2(g)=CO(g) △H=﹣393.5kJ/mol
C.C+O2=CO2 △H=﹣393.5kJ/mol
D.C(s)+O2(g)=CO2(g) △H=﹣393.5kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铊(Tl)是某超导材料的组成元素之一,与铝同族,位于周期表第六周期。Tl3+与银在酸性溶液中发生反应:Tl3++2Ag![]() Tl++2Ag+,下列推断正确的是( )
Tl++2Ag+,下列推断正确的是( )
A.Tl+的最外层有1个电子B.Tl能形成+3价和+1价的化合物
C.Tl3+氧化性比铝离子弱D.Tl+的还原性比Ag强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积一定的密闭容器中加入等物质的量的X、Y,进行如下可逆反应:X(g)+Y(g)![]() Z(g)+W(s) ΔH>0,下列叙述正确的是
Z(g)+W(s) ΔH>0,下列叙述正确的是
A. 平衡后若继续充入X,平衡正向移动,Y的转化率增大
B. 平衡后若升高体系温度,平衡逆向移动,Z的体积分数减小
C. 平衡后若移走部分W,平衡正向移动
D. 平衡后若移走部分X,上述反应的ΔH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有34 g某气体,它们的摩尔质量为17 g·mol-1。则:
①该气体的物质的量为______mol。
②该气体所含分子数为______NA。
③该气体在标准状况下的体积为______L。
④该气体完全溶解于500 mL水后稀释到2 L,物质的量浓度为______mol·L-1。
(2)______g H2O中的氧原子数目与标准状况下22.4 L CO2 中的氧原子数目相同。
(3)摩尔质量是指单位物质的量的物质所具有的质量。
①已知NH3的相对分子质量为17,则NH3的摩尔质量为_____。
②NA 为阿伏加德罗常数,已知a g 某气体中含分子数为b,则该气体的摩尔质量为_____。
③已知一个铁原子的质量为b g,则铁原子摩尔质量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
第二周期 | ① | ② | ③ | |||||
第三周期 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
第四周期 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:__(填元素符号),
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子__,碱性最强的化合物的电子式是:__。
(3)用电子式表示元素④与⑥的化合物的形成过程:__。
(4)表示①与⑦的化合物的电子式__,该化合物是由__(填“极性”或“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是_(用化学式表示)。
(6)元素③的简单氢化物的结构式__,在常温下和元素⑦的单质反应的离子方程式__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com