
����Ŀ��������������ɫ����ˮ����ζ��Һ�壬�е�Ϊ 77.2 ����ʵ����ij����ȡ���������ñ����ᡢ�Ҵ���Ũ���ᡢ����̼������Һ�Լ��������Ҵ���ϵ��Ȼ�����Һ����Ҫװ������ͼ��ʾ��
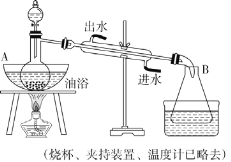
ʵ�鲽�裺
������ A �е�������ƿ��ע�������Ҵ���Ũ�����ҡ�ȣ��ٽ�ʣ�µ������Ҵ��ͱ�����ע���Һ©������á�
��������ԡ���¡�
������Һ©���е�Һ�建������������ƿ�
���ڼ������ʣ�ʹ��������������������ʴ�����ȣ�ֱ��������ɡ�
��������ԡ�¶�һ��ʱ�䣬��������Һ�������ֹͣ���ȡ�
��ȡ�� B �е���ƿ����һ�������� Na2CO3 ��Һ����������εؼӵ����Һ��ӱ����������ݲ���Ϊֹ��
��������Һ�������÷�Һ©����Һ����ȥˮ�㡣
�������� CaCl2 ��Һ(����)�����Һ©���У���һ��ʱ����ã��ų�ˮ��(��Һ)��
����Һ©����õ����dz����ᴿ������������Ʒ��
(1)ʵ����Ũ�������Ҫ������_____��
(2)�ñ��� Na2CO3 ��Һϴ�Ӵ�����Ŀ����_____���ñ��� CaCl2��Һϴ�Ӵ�����Ŀ����_____��
(3)�ڲ��������õĴ����ﻹ���е�������_____��
(4)д����ʵ����ȡ���������Ļ�ѧ����ʽ��_____��
(5)���� 46g �Ҵ��� 30g ���ᷴӦ�����ʵ�ʲ��������۲��ʵ� 65%���Լ���ɵõ�����������������Ϊ______��
���𰸡���������ˮ�� �к����ᡢ�ܽ��Ҵ������������������ܽ�� ��ȥ�Ҵ� ˮ CH3COOH+C2H5OH![]() CH3COOCH2CH3+H2O 28.6g
CH3COOCH2CH3+H2O 28.6g
��������
�������Ҵ���Ũ���������������·���������Ӧ��������������ͬʱ����������������������ȴ���ñ���̼������Һ��Һ���գ������ѧ֪ʶ���н��⡣
(1) �������Ҵ�����������Ӧ����Ũ�������������ӿ췴Ӧ���ʣ��÷�ӦΪ���淴Ӧ��Ũ������ˮ����ƽ���������������������ƶ�������Ũ���������Ϊ��������ˮ����
(2) �Ʊ���������ʱ���ñ���̼������Һ��Ŀ�����кͻӷ����������ᣬʹ֮ת��Ϊ����������ˮ�У�������������������ζ���ܽ�ӷ��������Ҵ�����������������ˮ�е��ܽ�ȣ����ڷֲ�õ����������ñ��� Na2CO3 ��Һϴ�Ӵ�����Ŀ�����к����ᡢ�ܽ��Ҵ������������������ܽ�ȣ��Ȼ�����Һ�������Ҵ���ϳ���ˮ�����˱���CaCl2��Һ�����������������п��ܲ������Ҵ������ñ��� CaCl2��Һϴ�Ӵ�����Ŀ���dz�ȥ�Ҵ���
(3) ����̼������Һ������������Ҵ�������CaCl2��Һ�����������������п��ܲ������Ҵ�������������Ĵ����лẬ������ˮ��
(4) �������Ҵ�����������Ӧ����ȥ�ǻ���ȥ�⣬��ȡ���������Ļ�ѧ����ʽΪCH3COOH+C2H5OH![]() CH3COOCH2CH3+H2O��
CH3COOCH2CH3+H2O��
(5) ���ݷ���ʽCH3COOH+C2H5OH![]() CH3COOCH2CH3+H2O����֪60g ������46g �Ҵ�ǡ����ɷ�Ӧ����46g �Ҵ��� 30g ���ᷴӦʱ���Ҵ�������
CH3COOCH2CH3+H2O����֪60g ������46g �Ҵ�ǡ����ɷ�Ӧ����46g �Ҵ��� 30g ���ᷴӦʱ���Ҵ�������
CH3COOH + C2H5OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
![]()
���m������������=28.6g��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�ص��ʼ��仯�����й㷺��;����������ڱ��е�������Ԫ�����֪ʶ�ش��������⣺
(1)��ԭ������������˳��ϡ��������⣩������˵����ȷ����______��
a��ԭ�Ӱ뾶�����Ӱ뾶����С
b�������Լ������ǽ�������ǿ
c�����ʵ��۵㽵��
d���������Ӧ��ˮ������Լ�����������ǿ
ԭ�������������������������ͬ��Ԫ������Ϊ_____�������������ļ���������____��
(2)��֪��
������ | MgO | Al2O3 | MgCl2 | AlCl3 |
���� | ���ӻ����� | ���ӻ����� | ���ӻ����� | ���ۻ����� |
�۵�/�� | 2800 | 2050 | 714 | 191 |
��ҵ��þʱ�����MgCl2�������MgO��ԭ����_____������ʱ�����Al2O3�������AlCl3��ԭ����_____��
(3)����裨�۵�1410���������õİ뵼����ϡ��ɴֹ��ƴ���������£�
Si���֣�![]() SiCl4
SiCl4![]() SiCl4������
SiCl4������![]() Si������
Si������
д��SiCl4�ĵ���ʽ��_____��
(4)�������岻����Ũ����������P2O5�������_____��
a.NH3 b.HI c.SO2 d.CO2
(5)KClO3������ʵ������O2�������Ӵ�����400��ʱ�ֽ�ֻ���������Σ�����һ�����������Σ���һ���ε��������Ӹ�����Ϊ1��1��д���÷�Ӧ�Ļ�ѧ����ʽ��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����л��� ![]() (x)
(x) ![]() (y)
(y)![]() (z)������˵������ȷ����
(z)������˵������ȷ����
A.x��y��z ��Ϊͬ���칹�壬z �Ķ��ȴ���������
B.x��y ��һ�ȴ����ֻ�����֣�z ��һ�ȴ�����һ��
C.x��y ��ʹ������Ȼ�̼��Һ�����ӳɷ�Ӧ����ɫ
D.x��y��z ��ֻ�� x ������ԭ�ӿ��ܴ���ͬһƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ���ǹ�ҵ��ͭ����Ҫԭ�ϣ�����Ҫ�ɷ�ΪCuFeS2������һ����Ȼ��ͭ��������ʯ����Ϊ�˲ⶨ�û�ͭ��Ĵ��ȣ�ijͬѧ���������ʵ�飺
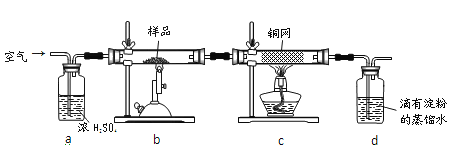
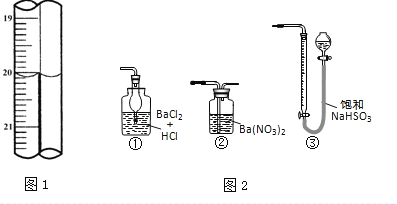
�ֳ�ȡ��ϸ�Ļ�ͭ����Ʒ1.150g���ڿ��������½������գ�����Cu��Fe3O4��SO2���壬ʵ���ȡd����Һ��1/10������ƿ�У���0.05mol/L������Һ���еζ���������Ϊ0.00mL��ĩ������ͼ1��ʾ�����������գ�
��1��������Ʒ���õ�����Ϊ___������Ʒ��ϸ���ٷ�Ӧ����Ŀ����__________��
��2��װ��a��������___________��������Ӧ����������ͨһ��ʱ��Ŀ�������Ŀ����___��
��3���ζ�ʱ��������Һ�������Ϊ___mL���жϵζ��Ѵ��յ��������_____________��
��4��ͨ�������֪���û�ͭ��Ĵ���Ϊ_________��
��5������ͼ2װ���������ʵ��װ��d��ͬ�����Դﵽʵ��Ŀ�ĵ���________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л�������У����е�ԭ����������ͬһƽ���ϵ��� (�� ��)
A. CH2=CH-C��NB. CH2=CF-CF=CH2C. 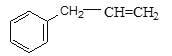 D.
D. ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�� A��B��C��D �ֱ����������ķ��ӽṹ����ش��������⣺
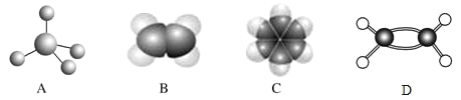
(1)��ͼ�� D ���л�����ӵ�_____ģ�ͣ�
(2)�� A ����ͬϵ��ķ���ʽ����ͨʽ_____(̼ԭ�Ӹ����� n ��ʾ)���� n��6 ʱ��ͬ���칹����ĿΪ_____(������)�֣�
(3)���������л������У�����ԭ�Ӿ���ƽ�����_________(���л��������)��
(4)���й����� C ��������ȷ����_____(�����)��
A������ʽΪ C6H6��������ʹ���� KMnO4 ��Һ��ɫ�����ڱ�����
B���ӷ��ӽṹ����C �����к���̼̼˫��������ϩ��
C���� C ��ͬϵ����ױ�(C8H10)�����ֲ�ͬ�Ľṹ�������ڷ�����
D���� C �м�����ˮ����������ã��²���ɫ
(5)�ֱ�д�� B ʹ��ˮ��ɫ��C �������Ӧ�Ļ�ѧ����ʽ____________��_____________����ָ����Ӧ���ͣ�________________��______________
(6)C ��ͬϵ��ױ������������ӳɺ�IJ���(��������)��һ�ȴ�����_____�֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� lmol̼��ȫȼ�պ�ɷų�393.5KJ�������������Ȼ�ѧ����ʽ��ȷ������ ��
A��C(s)+O2(g)=CO2(g) ��H=+393.5kJ/mol
B��C(s)+![]() O2(g)=CO(g) ��H����393.5kJ/mol
O2(g)=CO(g) ��H����393.5kJ/mol
C��C+O2=CO2 ��H����393.5kJ/mol
D��C(s)+O2(g)=CO2(g) ��H����393.5kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����һ�����ܱ������м�������ʵ�����X��Y���������¿��淴Ӧ��X(g)+Y(g)![]() Z(g)+W(s)����H>0������������ȷ����
Z(g)+W(s)����H>0������������ȷ����
A. ƽ�������������X��ƽ�������ƶ���Y��ת��������
B. ƽ�����������ϵ�¶ȣ�ƽ�������ƶ���Z�����������С
C. ƽ��������߲���W��ƽ�������ƶ�
D. ƽ��������߲���X��������Ӧ����H��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��Z��ԭ���������������ͬһ��ͬ��Ԫ�أ�W��X�ǽ���Ԫ�أ�Y��Z�Ƿǽ���Ԫ�ء�
(1)W��X���Ե�����������Ӧ��ˮ������Է�Ӧ�����κ�ˮ���÷�Ӧ�����ӷ���ʽΪ_____________
(2)W��Y ���γɻ�����W2Y���û�����ĵ���ʽΪ________________________��
(3)Y�ĵͼ�������ͨ��Z���ʵ�ˮ��Һ�У�������Ӧ�Ļ�ѧ����ʽΪ_________________________��Y������������Ƿ�����8�����ȶ��ṹ______________(����.��)
(4)�Ƚ�Y��Z��̬�⻯����ȶ����ɴ�С��˳����________________(�÷���ʽ��ʾ)��
(5)W��X��Y��Z����Ԫ�ؼ����ӵ����Ӱ뾶�ɴ�С��˳����
____________________________________________________��(�����ӷ��ű�ʾ)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com