
【题目】化合物YX2、ZX2中,X、Y、Z的核电荷数小于18;X原子最外能层的p能级中有一个轨道充填了2个电子,Y原子的最外层中p能级的电子数等于前一能层电子总数,且X和Y具有相同的电子层数;Z与X在周期表中位于同一主族。回答下列问题:
(1)X的电子排布式为______________,Y的轨道表示式为_________________;
(2)YX2的电子式是______________,分子构型为_________,中心原子发生了____杂化。
(3)Y与Z形成的化合物的分子式是_______,该化合物中化学键是________键(填“极性”或“非极性”),该分子属于__________分子(填“极性”或“非极性”)。
(4)Y的氢化物中分子构型为正四面体的是_______(填名称),键角为_______,中心原子的杂化形式为_______。
【答案】1s22s22p4 ![]()
![]() 直线型 sp CS2 极性 非极性 甲烷 109°28 sp3
直线型 sp CS2 极性 非极性 甲烷 109°28 sp3
【解析】
化合物YX2、ZX2中X、Y、Z的核电荷数小于18,三元素处于短周期,Y原子的最外层中p能级的电子数等于前一能层电子总数,Y原子只能有2个能层,核外电子排布为1s22s22p2,故Y为碳元素;X原子最外能层的p能级中有一个轨道充填了2个电子,外围电子排布为ns2np4,处于ⅥA族,且X和Y具有相同的电子层数,故X为O元素;Z与X在周期表中位于同一主族,则Z为S元素,据此分析解答。
根据上述分析,X为O元素,Y为碳元素,Z为S元素。
(1)X为O元素,其电子排布式为1s22s22p4,Y为C元素,原子核外电子排布为1s22s22p2,故其轨道表示式为![]() ,故答案为:1s22s2p4;
,故答案为:1s22s2p4;![]() ;
;
(2)YX2为CO2,分子中C原子与O原子之间形成2对共用电子对,C的价层电子对数=2+![]() =2,C采用sp杂化,为直线型,其电子式是
=2,C采用sp杂化,为直线型,其电子式是![]() ;故答案为:
;故答案为:![]() ;直线形;sp;
;直线形;sp;
(3)C与S形成的化合物是CS2,CS2中碳原子和硫原子之间存在极性键,C的价层电子对数=2+![]() =2,C采用sp杂化,为直线型,分子中正负电荷中心重合,为非极性分子,故答案为:CS2;极性键;非极性;
=2,C采用sp杂化,为直线型,分子中正负电荷中心重合,为非极性分子,故答案为:CS2;极性键;非极性;
(4)Y的氢化物中分子构型为正四面体的是甲烷,甲烷分子中碳原子含有4个共价单键,且不含孤电子对,所以碳原子采用sp3杂化,所以分子为正四面体型,键角为109°28′,故答案为:甲烷;109°28′;sp3。


科目:高中化学 来源: 题型:
【题目】体积一定的密闭容器中加入等物质的量的X、Y,进行如下可逆反应:X(g)+Y(g)![]() Z(g)+W(s) ΔH>0,下列叙述正确的是
Z(g)+W(s) ΔH>0,下列叙述正确的是
A. 平衡后若继续充入X,平衡正向移动,Y的转化率增大
B. 平衡后若升高体系温度,平衡逆向移动,Z的体积分数减小
C. 平衡后若移走部分W,平衡正向移动
D. 平衡后若移走部分X,上述反应的ΔH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为_____________
(2)W与Y 可形成化合物W2Y,该化合物的电子式为________________________。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为_________________________。Y的最高价氧化物是否满足8电子稳定结构______________(填是.否)
(4)比较Y、Z气态氢化物的稳定性由大到小的顺序是________________(用分子式表示)。
(5)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是
____________________________________________________。(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
第二周期 | ① | ② | ③ | |||||
第三周期 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
第四周期 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:__(填元素符号),
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子__,碱性最强的化合物的电子式是:__。
(3)用电子式表示元素④与⑥的化合物的形成过程:__。
(4)表示①与⑦的化合物的电子式__,该化合物是由__(填“极性”或“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是_(用化学式表示)。
(6)元素③的简单氢化物的结构式__,在常温下和元素⑦的单质反应的离子方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值。下列说法正确的是
A.2.4 g Mg与足量硝酸反应生成NO和![]() 的混合气体,失去的电子数为
的混合气体,失去的电子数为![]()
B.1 mol甲苯分子中所含单键数目为![]()
C.![]() 的
的![]() 溶液中,由水电离出的H+数目一定是
溶液中,由水电离出的H+数目一定是![]()
D.![]() 、
、![]() 和
和![]() 的混合气体中所含分子数为
的混合气体中所含分子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20 mL某物质的量浓度的AlCl3溶液中滴入2 mol·L-1NaOH溶液时,得到的Al(OH)3沉淀质量与所滴加的NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
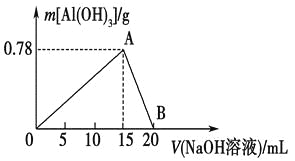
(1)图中A点表示的意义是_________________________。
(2)图中B点表示的意义是_________________________。
(3)上述两步反应用总的离子方程式可表示为:____________________________。
(4)若所得Al(OH)3沉淀0.39 g,则此时用去NaOH溶液的体积为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设计一个简单的一次性完成实验的装置图,验证醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱顺序是CH3COOH>H2CO3>C6H5OH。
(1)利用如图所示的仪器可以组装实验装置,则仪器的连接顺序是____接D、E接_____、______接_____。
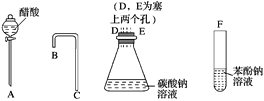
(2)有关反应的化学方程式为________________________________________________。
(3)有的同学认为此装置不能验证H2CO3和C6H5OH的酸性强弱,你认为________(填“有”或“没有”)道理。怎样改进实验才能验证H2CO3和C6H5OH的酸性强弱?
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水杨酸是合成阿司匹林的重要原料。水杨酸的学名邻羟基苯甲酸,结构简式为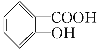 ,请回答下列问题:
,请回答下列问题:
(1)请写出水杨酸中具有的官能团名称________;
(2)能够区分水杨酸和苯酚的试剂_____ ___;
A.浓溴水 B.氢氧化钠溶液 C.氯化铁溶液 D.碳酸氢钠溶液
(3)水杨酸的另一种同分异构体的结构简式为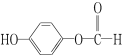 ,1 mol该有机物在适宜条件下与氢氧化钠经过一系列反应,最多能消耗氢氧化钠的物质的量为(填序号)________;
,1 mol该有机物在适宜条件下与氢氧化钠经过一系列反应,最多能消耗氢氧化钠的物质的量为(填序号)________;
A.1 mol B.2 mol C.3 mol D.4 mol
(4)已知有机物CH3COOH可以表示为:![]() ,在一定条件下,水杨酸与乙酸酐可合成阿司匹林,阿司匹林可表示为:
,在一定条件下,水杨酸与乙酸酐可合成阿司匹林,阿司匹林可表示为: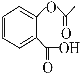 ,则阿司匹林分子式为________;
,则阿司匹林分子式为________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com