
| A、含大量Fe3+的溶液中:NH4+、Mg2+、Cl-、HSO3- |
| B、加入Al有H2生成的溶液中:Na+、K+、Cl-、NO3- |
| C、NaOH溶液中:K+、Na+、AlO2-、CO32- |
| D、NaHCO3溶液中:K+、Al3+、Cl-、SO42-、 |


科目:高中化学 来源: 题型:
A、 用装置制取少量H2: |
B、 用装置分离Na2CO3溶液和CH3COOC2H5的混合物 |
C、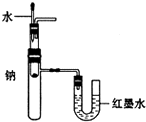 用装置验证Na和水反应的热效应 |
D、 用装置蒸干A1Cl3溶液制备无水AlC13 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“水滴石穿”是溶解了CO2的雨水与CaCO3长期作用生成了可溶解的Ca(HCO3)2的缘故 |
| B、地沟油由于混有一些对人体有害的杂质而不能食用,可加工制成和从石油中提取的柴油成分完全相同的生物柴油 |
| C、长期盛放NaOH溶液的滴瓶不易打开,主要是由于NaOH能与玻璃中的SiO2反应生成硅酸钠导致瓶塞粘住的缘故 |
| D、黄铜(铜锌合金)不易产生铜绿,这是因为发生电化学腐蚀时,锌被腐蚀而保护了铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④ | B、①③ | C、②③ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 50-80℃ |
| 180-200℃ |

查看答案和解析>>
科目:高中化学 来源: 题型:
 NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用.下列说法正确的是( )
NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用.下列说法正确的是( )| A、O2在石墨Ⅱ附近发生氧化反应 |
| B、该电池放电时NO3-向石墨Ⅱ电极迁移 |
| C、石墨Ⅰ附近发生的反应:3NO2+2e-=NO+2NO3- |
| D、相同条件下,放电过程中消耗的NO2和O2的体积比为4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢化物的沸点:HF<HCl<HBr<HI |
| B、CaF2、CaCl2、CaBr2、CaI2的溶解性依次减小 |
| C、AgF、AgCl、AgBr、AgI的溶解性依次减小 |
| D、F2、Cl2、Br2、I2氧化性逐渐减弱,都能与Fe反应生产Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热、加压 |

| 物质 | CH3OH | CH3OCH3 | H2O |
| c/mol?L-1 | 0.44 | 0.60 | 0.60 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com