
【题目】现有73 g HCl气体,若阿伏加德罗常数用NA表示,则:
(1)HCl气体的物质的量为_______mol。
(2)HCl气体所含原子总数为_______个。
(3)HCl气体在标准状况下的体积为________L。
(4)HCl气体溶于水后形成2 L溶液,其溶液的物质的量浓度为_________mol/L。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】NH3是重要的化工原料,经一系列反应可得到HNO3、CO(NH2)2、HCN等产品。
(1)以氨气为原料合成HNO3工艺如下,写出N2O4转化为HNO3的反应方程式_____。
![]()
(2)以NH3和CO2为原料生产尿素的反应如下:
反应Ⅰ:2NH3(l) + CO2(g) ![]() NH2COONH4(l) Δ H1 = a kJ·mol-1
NH2COONH4(l) Δ H1 = a kJ·mol-1
反应Ⅱ:NH2COONH4(l) ![]() NH2CONH2(l) + H2O(l) Δ H2 = b kJ·mol-1
NH2CONH2(l) + H2O(l) Δ H2 = b kJ·mol-1
① 已知NH3(l) ![]() NH3(g) Δ H3 = c kJ·mol-1 反应2NH3(g) + CO2(g)
NH3(g) Δ H3 = c kJ·mol-1 反应2NH3(g) + CO2(g) ![]() NH2CONH2(l) + H2O(l) Δ H4=_____kJ·mol-1(用含a、b、c的式子表示),该反应能自发进行的主要原因是_____。
NH2CONH2(l) + H2O(l) Δ H4=_____kJ·mol-1(用含a、b、c的式子表示),该反应能自发进行的主要原因是_____。
② 一定条件下,往恒容密闭容器中投入4 mol NH3和 1 mol CO2,测得各组分物质的量随时间变化如图1。下列说法正确的是_____。
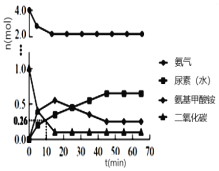
A.选择合适的碳氮比有利于提高产率
B.反应Ⅰ的活化能比反应Ⅱ小
C.过量氨气可以与反应生成的水结合,有利于尿素合成
D.气体物质的量不再变化时,反应达到平衡状态
(3)工业上利用氨气生产氢氰酸的反应为CH4(g) + NH3(g) ![]() HCN(g) + 3H2(g) Δ H>0
HCN(g) + 3H2(g) Δ H>0
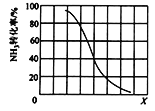
① 其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。X代表的是_____(填“温度”或“压强”)。

② 其它条件一定时,向2 L密闭容器中加入n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如图所示。平衡常数K=_____(请写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列说法中正确的是( )
A.含0.1molBaCl2的溶液中Cl-数为0.1NA
B.22gCO2所含有的分子数为0.5NA
C.11.2LCO2所含有的分子数为0.5NA
D.标准状况下1mol乙醇分子所占有的体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系。已知在常温常压下,A是固体,B、C、D、E是非金属单质且都是气体,C呈黄绿色;化合物F是淡黄色固体,化合物G的焰色反应为黄色,化合物Ⅰ和J通常状况下呈气态;D和E反应生成一种刺激性气味的气体。
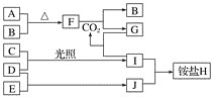
请回答下列问题:
(1)E和J的化学式分别是________和________。
(2)写出F和CO2反应的化学方程式并用单线桥法表示电子转移的情况:_________。
(3)将少量单质C通入盛有淀粉碘化钾溶液的试管中,溶液变蓝色,该反应的离子方程式为_________。
(4)标况下3.36 L气体B与A完全反应,转移电子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某温度下,将足量的BaSO4固体溶于一定量水中达到溶解平衡后,假定溶液体积不变的情况下,加入Na2CO3使c(CO32-)增大过程中,溶液中c(Ba2+)和c(SO42-)的变化曲线。根据图中的数据分析,下列说法正确的是:
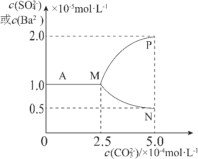
A.该温度下BaSO4的Ksp=2.5×10-9mol2·L-2
B.图中表示c(Ba2+)的曲线是MP
C.反应BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq)的平衡常数K=0.04
BaCO3(s)+SO42-(aq)的平衡常数K=0.04
D.如用1LNa2CO3溶液将0.1molBaSO4固体完全转化为BaCO3,则原Na2CO3溶液浓度至少为2.5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,发生反应2NO2(g)![]() N2O4(g)ΔH<0。反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示。
N2O4(g)ΔH<0。反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示。
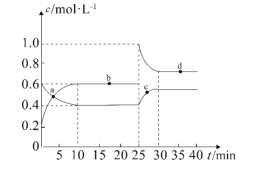
①0~10min的平均反应速率:v((NO2)=___________mol·L-1·min-1。
②a、b、c、d四个点中,表示化学反应速率v(正)>v(逆)的点是___________。
③上述反应反应进行到25min时,继续向容器内充入一定量NO2,重新达到平衡后,混合气体中NO2的体积分数将___________(填“增大”“不变”或“减小”)。该反应的平衡常数K=___________(计算结果保留1位小数)。
(2)一定温度下恒容容器中,反应2N2O(g)![]() 2N2(g)+O2(g),在碘蒸气存在时能大幅度提高N2O的分解速率,反应历程为:
2N2(g)+O2(g),在碘蒸气存在时能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)![]() 2I(g)(快反应)
2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是___________(填标号)。
a.N2O分解反应中,k(含碘)>k(无碘)b.第一步对总反应速率起决定作用
c.第二步活化能比第三步大d.I2浓度与N2O分解速率无关
(3)F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
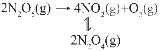
其中NO2二聚为N2O4的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 36.0 | 40.5 | 42.6 | 45.9 | 49.2 | 61.2 | 62.3 | 64.0 |
①25℃时2NO2(g)![]() N2O4(g)反应的平衡常数Kp=___________kPa-1。
N2O4(g)反应的平衡常数Kp=___________kPa-1。
②t=200min时,测得体系中p(N2O4)=6.5kPa,则此时的N2O5转化率为___________。(计算结果保留1位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需配制0.10 mol·L-1 NaCl溶液250 mL。
(1)容量瓶上需要标有_________。
①温度 ②浓度 ③容量 ④压强 ⑤刻度线 ⑥酸(碱)式
(2)按下列操作步骤填上适当的文字,以使整个操作完整。
第一步:选择仪器。完成本实验所必需的仪器有:
天平(精确到0.1 g)、药匙、_____、_____、_____、_____以及等质量的两片纸。
第二步:计算。配制该溶液需取NaCl晶体______g。
第三步:称量。
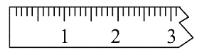
①天平调平之后,应将天平的游标调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:______
②称量过程中NaCl晶体应放于天平的________(填“左盘”或“右盘”)。
③称量完毕,将药品倒入________中。
第四步:__________,该步实验中还需进行的动手操作是: _________________________________
第五步:转移、洗涤。
第六步:_____________________________________。
第七步: ____________________________________。
第八步:将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、名称及浓度。
(3)定容摇匀后,某同学发现液面略低于刻度线,又用蒸馏水添加至刻度线。该操作是否会对所配制的溶液浓度造成影响?为什么?_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:实验一:焦亚硫酸钠的制取采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2=Na2S2O5。
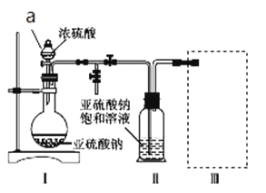
(1)加试剂前要进行的操作是__。装置Ⅰ中产生气体的化学方程式为__。
(2)从装置Ⅱ中分离出产品可采取的分离方法是__。
(3)为了完整实验装置,在下列装置中选择一个最合理的装置放在装置Ⅲ处,可选用的装置(夹持仪器已略去)为__(填序号)。
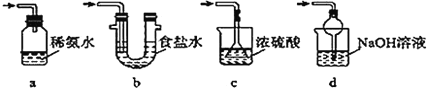
实验二:葡萄酒中抗氧化剂残留量的测定
(4)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如图:
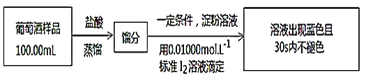
(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液30.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为__g·L-1。
②若实验过程中有部分HI被空气氧化,则测定结果__(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
A.将混合气体中的氨液化有利于合成氨反应
B.对CO(g)+NO2(g)![]() CO2(g)+NO(g)平衡体系增大压强可使其颜色变深
CO2(g)+NO(g)平衡体系增大压强可使其颜色变深
C.常温下,将1mLpH=3的醋酸溶液加水稀释到100mL,测得其pH<5
D.实验室中常用排饱和食盐水的方法收集氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com