
| V |
| Vm |
| 21.28L |
| 22.4L/mol |
| 27g/mol×0.5mol |
| 18.3g |


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
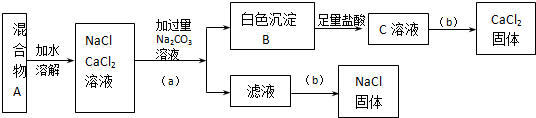
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液时,上下层液体均从下口放出 |
| B、蒸馏时忘记放碎瓷片可停止加热,冷却后补加 |
| C、蒸发结晶时,应将蒸发皿中的溶液全部蒸干 |
| D、过滤时,为加快过滤速度可搅拌漏斗内的液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | Cu2+ | Al3+ | NO | Cl- |
| 物质的量浓度(mol/L) | 1 | 1 | a | 1 |
| A、电解后溶液的pH=0 |
| B、a=3 |
| C、阳极生成1.5 mol Cl2 |
| D、阴极析出的金属是铜与铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏烧瓶中温度计的水银球应插入到液体内 |
| B、蒸馏装置中冷凝管进出水的方向是下口进、上口出 |
| C、在蒸馏烧瓶内放入少量碎瓷片,目的是防止暴沸 |
| D、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com