
【题目】等物质的量的氢气和氦气在同温同压下具有相同的( )
A.原子数B.体积C.中子数D.质量
科目:高中化学 来源: 题型:
【题目】SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,某学习小组为了探究二氧化硫的某些性质,进行了如下实验。
I.如下图所示,使用药品和装置一探究二氧化硫的还原性:
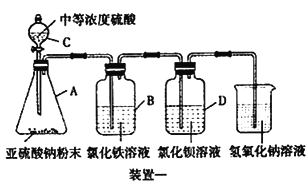
(1)装置C的名称为________。
(2)B中溶液的现象为________。
(3)学生甲预测装置D 中没有白色沉淀产生,但随着反应的进行,发现D 中产生了少量白色沉淀。学生乙经过查阅资料发现少量白色沉淀可能是硫酸钡,因为装置或溶液中少量的氧气参与了氧化反应,请写出装置D 中的反应方程式________。
II.经过思考,设计了如下装置二,且所配制的溶液均使用无氧蒸馏水,检验SO2 在无氧干扰时,是否与氯化钡反应生成沉淀。
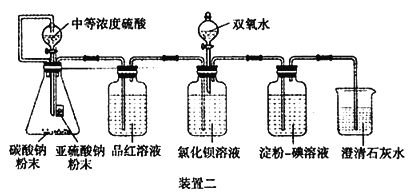
(4)碳酸钠粉末的目的是________。
(5)当______时,氯化钡溶液中没有沉淀出现,说明二氧化硫不与氯化钡溶液反应,此时滴加双氧水,出现了白色沉淀。
(6)裝置二选用澄清石灰水而不用氢氧化钠溶液的目的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1mol·L-1的H2A溶液中各种微粒浓度的对数值(lgc)与pH的关系如图所示。
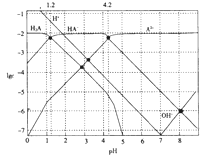
下列说法不正确的是
A. H2A是二元弱酸
B. HA-![]() H++A2-的电离平衡常数Ka=10-12
H++A2-的电离平衡常数Ka=10-12
C. 0.1mol·L-1的H2A溶液中:c(H+)=c(HA-)+2c(A2-)+c(OH-)
D. pH=4.2 时:c(HA-)=c(A2-)>c(H+)>c(H2A)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向Na2SiO3溶液中通入适量CO2气体 | 出现白色沉淀 | H2CO3的酸性比H2SiO3强 |
B | 向无色溶液中加硝酸酸化的BaCl2溶液 | 有白色沉淀 | 原溶液中一定含SO |
C | 将气体X通入品红溶液中 | 红色褪去 | X一定是SO2 |
D | 向某溶液中先加氯水再加KSCN溶液 | 溶液呈血红色 | 原溶液中一定含Fe2+ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
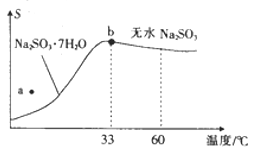
【题目】利用废碱渣(主要成分为Na2CO3)处理硫酸厂尾气中的SO2,可制得无水Na2SO3(成品),其流程如图所示。
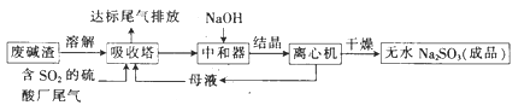
(1)某硫酸厂排放出的尾气中SO2的含量特别髙,而废碱渣的量不足,此时“吸收塔”内发生反应的离子方程式为_______________(不考虑H2O与SO2反应)。
(2)亚硫酸钠的溶解度曲线如图所示,则上述流程中“结晶”的方法是___________(填“蒸发结晶”或“降温结晶”),图中a点所示分散系类别为____________(填“浊液”“胶体”或“溶液”)。
(3)仅用BaCl2、H2O2和过量稀盐酸的混合溶液难以检出“成品”中的SO32-,原因是“成品”中含有某种杂质阴离子。
①该杂质阴离子为________________(填离子符号)。
②25℃时,部分钡盐的Ksp如下表所示。
化学式 | BaSO4 | BaSO3 |
Ksp | 1.1×10-10 | 5.5×10-7 |
将得到的“成品”溶于水,测得溶液中SO32-的浓度为0.5mol L-1,为杂质阴离子浓度的10倍,向该溶液中加入等体积、0.5mol·L-1的BaCl2溶液,充分反应后c(Ba2+)=_______mol L-1。(混合时溶液体积的变化忽略不计)
(4)某同学采用如下方法检验SO32-:
![]()
①洗涤时使用的试剂最好为____________(填字母)。
a.稀HNO3 b.蒸馏水 c.稀H2SO4
②根据上述流程中的数据(w、x、y)_____________ (填“能”或“不能”)计算出成品试样中SO32-的百分含量,若能,则SO32-的百分含量为 (若不能,则此空不填);若不能,则理由是_____________(若能,则此空不填)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.1mo1/LHCl溶液滴定10.mL0.1mol·L-1Na2CO3溶液,滴定曲线如图所示。下列说法正确的是( )
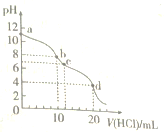
A. 水电离程度由大到小的顺序为:a>b>c>d
B. a点时:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)
C. b点时:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
D. d点时:c(H+)>c(HCO3-)=c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关NaOH固体必须存放在干燥密闭塑料容器里的原因中,错误的是( )
A.NaOH易水解B.NaOH易与CO2反应
C.NaOH易与SiO2反应D.NaOH易潮解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在化工生产和实验中有着广泛而重要的应用。
Ⅰ.利用含锰废水(主要含Mn2+、SO![]() 、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工艺流程如下:
、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工艺流程如下:

已知某些物质完全沉淀的pH如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Mn(OH)2 | CuS | MnS | MnCO3 |
沉淀完全时的pH | 3.2 | 5.4 | 6.4 | 9.8 | ≥0 | ≥7 | ≥7 |
回答下列问题:
(1)过程②中,所得滤渣W的主要成分是______________________。
(2)过程③中,发生反应的离子方程式是______________________。
(3)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3的反应的离子方程式是_______________________。
(4)由MnCO3可制得重要的催化剂MnO2:2MnCO3+O2===2MnO2+2CO2。现在空气中加热460.0 g MnCO3,得到332.0 g产品,若产品中杂质只有MnO,则该产品中MnO2的质量分数是________(用百分数表示,小数点后保留1位小数)。
Ⅱ.常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN/span> | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
(1)上述盐溶液中的阴离子,结合H+能力最强的是_______________________。
(2)根据表中数据判断,浓度均为0.01 mol·L-1的下列物质的溶液中,酸性最强的是________(填序号)。
A. HCN B. HClO C. C6H5OH D. CH3COOH E. H2CO3
Ⅲ.已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH = Q kJ·mol-1其平衡常数随温度变化如下表所示:
CO2(g)+H2(g) ΔH = Q kJ·mol-1其平衡常数随温度变化如下表所示:
温度/℃ | 400 | 500 | 850 |
平衡常数 | 9.94 | 9 | 1 |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为___,该反应的Q____(填“>”或“<”)0。
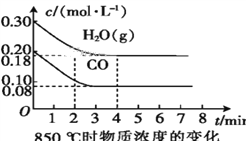
(2)850 ℃时,向体积为10 L的反应器中通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)的浓度变化如图所示,则0~4 min时平均反应速率v(CO)=____。
(3)若在500 ℃时进行上述反应,且CO、H2O(g)的起始浓度均为0.020 mol·L-1,该条件下,CO的最大转化率为____。
(4)若在850 ℃时进行上述反应,设起始时CO和H2O(g)共为1 mol,其中水蒸气的体积分数为x,平衡时CO的转化率为y,试推导y随x变化的关系式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成聚丙烯腈纤维的单体是丙烯腈,它可由以下两种方法制备:
方法一:CaCO3﹣→CaO ![]() CaC2
CaC2 ![]() CH≡CH
CH≡CH ![]() CH2═CH﹣CN
CH2═CH﹣CN
方法二:CH2═CH﹣CH3+NH3+ ![]() O2
O2 ![]() CH2═CH﹣CN+3H2O
CH2═CH﹣CN+3H2O
对以上两种途径的分析中,正确的是( )
①方法二比方法一反应步骤少,能源消耗低,成本低
②方法二比方法一原料丰富,工艺简单
③方法二比方法一降低了有毒气体的使用量,减少了污染
④方法二需要的反应温度高,耗能大.
A.①②③
B.①③④
C.②③④
D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com