
����Ŀ���ϳɾ۱�ϩ����ά�ĵ����DZ�ϩ�棬�������������ַ����Ʊ���
����һ��CaCO3����CaO ![]() CaC2
CaC2 ![]() CH��CH
CH��CH ![]() CH2�TCH��CN
CH2�TCH��CN
��������CH2�TCH��CH3+NH3+ ![]() O2
O2 ![]() CH2�TCH��CN+3H2O
CH2�TCH��CN+3H2O
����������;���ķ����У���ȷ���ǣ� ��
�ٷ������ȷ���һ��Ӧ�����٣���Դ���ĵͣ��ɱ���
�ڷ������ȷ���һԭ�Ϸḻ�����ռ�
�۷������ȷ���һ�������ж������ʹ��������������Ⱦ
�ܷ�������Ҫ�ķ�Ӧ�¶ȸߣ����ܴ�
A.�٢ڢ�
B.�٢ۢ�
C.�ڢۢ�
D.�٢ڢۢ�
���𰸡�A
���������⣺�ٸ��ݷ�Ӧԭ����֪���ٷ���2�ȷ���1��Ӧ�����٣���Դ���ĵͣ��ɱ��ͣ��ʢ���ȷ���ڸ��ݷ�Ӧԭ����֪������2�ȷ���1ԭ�ϱȽϷḻ�������ɹ��ռ��ʢ���ȷ���۷�������ʹ�����ж���HCN��������2�ȷ���1�������ж������ʹ�ã���������Ⱦ���ʢ���ȷ���ܷ�������̼�����Ҫ�����²��ֽܷ⣬���ܽϴ���2�ȷ���1��Ӧ��Ҫ��Ӧ�ͣ�����С���ʢܴ���ѡA��
�����㾫����ͨ��������þۺϷ�Ӧ��������Ӧ�����վۺϷ�Ӧ��ͨ���ӳɾۺϷ�Ӧ�γɸ߷��ӻ����������������ֻ�и߷��ӻ����������뵥����ͬ��������Ӧ�����봼�����á���������ˮ�ķ�Ӧ�����Խ����⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʵ����������ͺ�����ͬ��ͬѹ�¾�����ͬ�ģ� ��
A.ԭ����B.���C.������D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�������ᷢչϢϢ��أ�����˵������ȷ����
A.�����������Ѽ�·�������������γɵ����ܽ��ж����ЧӦ
B.������һ�գ���ˮ�����գ���ȡ֭����ʫ���������϶������ص���ȡ���ڻ�ѧ�仯
C.����������������֮�Ϊͭ�����ù��̷������û���Ӧ
D.�����ϵ���˿����������ɻ���ʼ���� ʫ�����漰������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�ʾ��Ӧ��ѧ��Ӧ�����ӷ���ʽ��ȷ���ǣ� ��
A.���������ڴ�����Һ��C6H5O��+H+��C6H5OH
B.��ϡ�����ȥ�Թ��ڱ�����Ag+2H++NO3���TAg++NO2��+H2O
C.����ˮ�ⷴӦ��CH3CH2OOCCH3+H218O ![]() CH3CH2OH+CH3CO18OH
CH3CH2OH+CH3CO18OH
D.��ȩ��������Ӧ��CH3CHO+2Ag��NH3��2OH ![]() CH3COO��+NH4++2Ag��+3NH3+H2O
CH3COO��+NH4++2Ag��+3NH3+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ǽ��л�ѧ�о�����Ҫ�ֶ�֮һ����ش��������⣺
��1��ʵ������Ҫ450 mL 1 mol��L��1������Һ��
������1 mol��L��1������ʱ�����������϶�����Ҫ����_________�����ţ�����ͼ�����������⣬����������Һ����Ҫ�IJ���������________________��
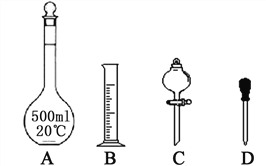
��������ƿ��ʹ�÷����У����в�����ȷ����_______����д��ţ���
a��ʹ������ƿǰ�����Ƿ�©ˮ
b������ƿ��ˮϴ�������ô�����Һϴ��
c������������Һʱ������Ͳ��ȡŨ������ò���������ע������ƿ�У�Ȼ���ˮ��
��2����ͼװ���У���A��ʢ��Ʒ����Һ��B��ʢ������������Һ��
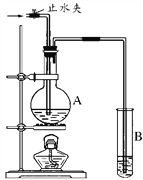
����A��ͨ��������SO2���壬Ȼ����ȣ�A�е�����_____________��
����A��ͨ��������Cl2���壬Ȼ����ȣ�A�е�������_____________��
������SO2��Cl2��1��1����ȣ�ͬ��ͬѹ��ͬʱͨ��A�У�����Һ����ɫ��ԭ����SO2��Cl2����Һ�з�����������ԭ��Ӧ����SO2���������÷�Ӧ�����ӷ���ʽ��______________________��
��3������2���е�A��ʢ����Ũ���ᣬ����������п�ر�ֹˮ�в����ȣ��������Һ������Ļ�ѧʽΪ____________�����з�����Ӧ�����ӷ���ʽ__________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CeO2��һ����Ҫ��ϡ������������÷�̼�����Ҫ�ɷ�ΪCeFCO3�����Ʊ����乤���������£�

��֪��I.Ce4+����SO42-��ϳ�[CeSO4]2+����F-��ϳ�[CeFx]��4-x��+��0<x<4��.
II.��������ϵ�У�Ce4+�ܱ���ȡ����ȡ��Ce3+���ܡ�
�ش��������⣺
��1�����������ա��С���������Ŀ����_________________��
��2��CeO2������ˮ�ͼ�����ᣬ����������ʱȴ���ܽ���ȫ��ԭ������Һ�е�_______����ԭ�ӷ��ţ���ͬ����__________��_____________�ٽ���CeO2���ܽ⡣
��3��������ȡ��ʱ������Ӧ�����ӷ���ʽΪ____________________��
��4����ȱ�١�ϴ������һ���ڣ������ò�Ʒ��������___________���ƫ��ƫС�����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɵ���߷��Ӳ���PPV �ķ�Ӧ�� ![]()
����˵����ȷ���ǣ� ��
A.�ϳ�PPV �ķ�ӦΪ�Ӿ۷�Ӧ
B.PPV ��۱���ϩ������ͬ���ظ��ṹ��Ԫ
C.![]() �ͱ���ϩ��Ϊͬϵ��
�ͱ���ϩ��Ϊͬϵ��
D.ͨ�������ⶨPPV ��ƽ����Է����������ɵ���ۺ϶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������NO3�������Ի���������¾��ɷ�Ӧ���ش��������⣺
��1��Ϊ�˽�������ˮ��NO3����Ũ�ȣ������ڼ��������������۽�NO3����ԭΪN2�����Ʋ���ƽ�÷�Ӧ��__Al +___NO3�� + ___OH�� = ____________+ ____N2�� + ____H2O��ÿ����1mol NO3����ת�Ƶĵ�����ĿΪ_____��
��2��ijͬѧȡһ�������������Ͻ���100mLxmol/Lϡ�����ַ�Ӧ����Ӧ������û������ų����ڷ�Ӧ���������Һ�У���μ���4 mol/L NaOH��Һ������NaOH��Һ�����(mL)��������������ʵ���(mol)�Ĺ�ϵ��ͼ��ʾ��

��д��EF�η�����Ӧ�����ӷ���ʽ_________________________________________��
�� C���Ӧ����Һ�к��е������ӳ�Na+�⣬������___________________________��
�� x=_________��
�������Ͻ����������ʵ�������Ϊ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25���101kPaʱ�����顢��Ȳ�ͱ�ϩ��ɵĻ����32mL�������������ϲ���ȫȼ�գ���ȥˮ�������ָ���ԭ�����¶Ⱥ�ѹǿ�������������С��72mL��ԭ��Ͼ�����Ȳ���������Ϊ�� ��
A.12.5%
B.25%
C.50%
D.75%
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com