
【题目】CeO2是一种重要的稀土氧化物,可利用氟碳铈矿(主要成分为CeFCO3)来制备。其工艺流程如下:

已知:I.Ce4+能与SO42-结合成[CeSO4]2+,与F-结合成[CeFx](4-x)+(0<x<4).
II.在硫酸体系中,Ce4+能被萃取剂萃取二Ce3+不能。
回答下列问题:
(1)“氧化焙烧”中“氧化”的目的是_________________。
(2)CeO2不溶于水和碱,微溶于酸,但“浸出”时却能溶解完全,原因是溶液中的_______(填原子符号,下同)、__________、_____________促进了CeO2的溶解。
(3)“反萃取”时发生反应的离子方程式为____________________。
(4)若缺少“洗氟”这一环节,则所得产品的质量将___________(填“偏大”“偏小”或“不变”)。
【答案】 将+3价铈氧化为+4价铈 H+ F- SO42- 2[CeSO4]2++H2O2===2Ce3++O2↑+2H++2SO42- 偏小
【解析】根据已知信息硫酸体系中Ce4+能被萃取剂萃取,而Ce3+不能,可推测第一步“氧化焙烧”的目的是将+3价铈氧化成+4价。第二步加入硫酸浸取,Ce4+与SO42-结合成[CeSO4]2+,Ce4+与F-结合成[CeFx](4-x)+;第三步加萃取剂,硫酸体系中Ce4+能被萃取剂萃取,Ce元素进入有机层;第四步,加入氟洗液,除去氟;第四步,加入硫酸和双氧水,根据后面的流程可知,此处双氧水为还原剂,将Ce4+还原为Ce3+,反萃取,Ce3+进入水层;加入碱后Ce3+转化为沉淀,通入氧气将Ce从+3价氧化为+4价,得到产品。
(1)“氧化焙烧”中“氧化”的目的是将+3价铈氧化成+4价,以便后续的提取。故答案为:将+3价铈氧化成+4价;
(2)CeO2微溶于酸,CeO2+4H+=Ce4++2H2O,根据信息Ce4+能与SO42-结合成[CeSO4]2+,与F-结合成[CeFx](4-x)+,故F、SO42促进了CeO2的溶解,故答案为:H+、F-、SO42-;
(3)反萃取时,H2O2为还原剂,将Ce4+还原为Ce3+,H2O2自身被氧化为O2,故离子方程式为:2[CeSO4]2++H2O2=2Ce3++O2↑+2H++2SO42-;
(4)若缺少“洗氟”, 部分Ce元素存在于[CeFx](4-x)+,难以被反萃取,进入有机层,则进入水层的Ce元素偏少,所得产品的质量将减少。故答案为:偏小。


科目:高中化学 来源: 题型:
【题目】室温下,用0.1mo1/LHCl溶液滴定10.mL0.1mol·L-1Na2CO3溶液,滴定曲线如图所示。下列说法正确的是( )
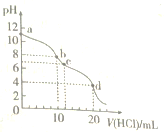
A. 水电离程度由大到小的顺序为:a>b>c>d
B. a点时:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)
C. b点时:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
D. d点时:c(H+)>c(HCO3-)=c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的气体,下列说法正确的是( ) 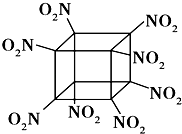
A.分子中C,N间形成非极性键
B.1mol该分子中含8mol 二氧化氮
C.该物质既有氧化性又有还原性
D.该物质爆炸产物是NO2、CO2、H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】善于归纳元素及其化合物之间的转化关系,对学习元素化合物具有重要意义。回答下列问题:
(1)置换反应是中学常见基本反应类型之一。
①写出金属单质置换出非金属单质的离子反应方程式_____________;
②写出非金属单质置换出非金属单质的化学方程式_____________。
(2)“三角转化”是单质及其化合物之间相互转化中常见的转化关系之一。现有如图转化关系。

①若Z是一种能够与血红蛋白结合造成人体缺氧的气体。则a的名称为___________;
②若X是一种常见金属单质,a为一种含氧酸。Y转化为Z的离子方程式___________。
③若X是一种强碱,a是一种酸性氧化物。Z转化为Y的离子反应方程式____________;
(3)在下图的转化关系中,A、B、C、D、E为含有一种相同元素的五种物质。

①若A为淡黄色固体单质,则B→D的化学方程式为_____________;
②若A常温下为气体单质,收集气体B采用的方法为________;若将32 g铜投入稍过量的E的浓溶液中,产生气体的体积为11.2 L(STP),参加反应的硝酸的物质的量为_____;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成聚丙烯腈纤维的单体是丙烯腈,它可由以下两种方法制备:
方法一:CaCO3﹣→CaO ![]() CaC2
CaC2 ![]() CH≡CH
CH≡CH ![]() CH2═CH﹣CN
CH2═CH﹣CN
方法二:CH2═CH﹣CH3+NH3+ ![]() O2
O2 ![]() CH2═CH﹣CN+3H2O
CH2═CH﹣CN+3H2O
对以上两种途径的分析中,正确的是( )
①方法二比方法一反应步骤少,能源消耗低,成本低
②方法二比方法一原料丰富,工艺简单
③方法二比方法一降低了有毒气体的使用量,减少了污染
④方法二需要的反应温度高,耗能大.
A.①②③
B.①③④
C.②③④
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠混合溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液分离以上混合液中各组分的正确方法依次是
A.分液、萃取、蒸馏B.分液、蒸馏、萃取
C.萃取、蒸发、分液D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
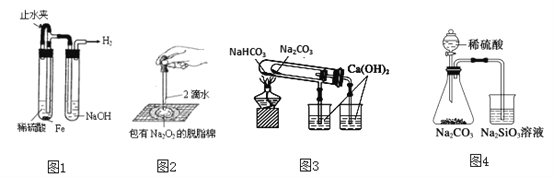
A. 图1:制备并观察氢氧化亚铁
B. 图2:证明过氧化钠与水反应放热
C. 图3:验证NaHCO3和Na2CO3的热稳定性
D. 图4:验证酸性强弱H2SO4>H2CO3>H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中微粒能大量共存,且当加入试剂后反应的离子方程式书写正确的是( )
选项 | 微粒组 | 加入试剂 | 发生反应的离子方程式 |
A | Fe3+、I-、Cl- | NaOH溶液 | Fe3++3OH-===Fe(OH)3↓ |
B | K+、NH3·H2O、CO | 通入少量CO2 | 2OH-+CO2===CO |
C | H+、Fe2+、SO | Ba(NO3)2溶液 | SO |
D | Na+、Al3+、Cl- | 少量澄清石灰水 | Al3++3OH-===Al(OH)3↓ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CH3CHO(易溶于水,沸点为20.8℃的液体)和CH3COOH分离的正确方法是 …( )
A.加热蒸馏
B.加入Na2CO3后,通过萃取的方法分离
C.先加入烧碱溶液,之后蒸出乙醛,再加入浓H2SO4 , 蒸出乙酸
D.和Na反应后进行分离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com