
����Ŀ�����ڹ���Ԫ�ؼ��仯����֮���ת����ϵ����ѧϰԪ�ػ����������Ҫ���塣�ش��������⣺
��1���û���Ӧ����ѧ����������Ӧ����֮һ��
��д�����������û����ǽ������ʵ����ӷ�Ӧ����ʽ_____________��
��д���ǽ��������û����ǽ������ʵĻ�ѧ����ʽ_____________��
��2��������ת�����ǵ��ʼ��仯����֮���ת���г�����ת����ϵ֮һ��������ͼת����ϵ��

����Z��һ���ܹ���Ѫ�쵰����������ȱ�������塣��a������Ϊ___________��
����X��һ�ֳ����������ʣ�aΪһ�ֺ����ᡣYת��ΪZ�����ӷ���ʽ___________��
����X��һ��ǿ�a��һ�������������ת��Ϊ�ٵ����ӷ�Ӧ����ʽ____________��
��3������ͼ��ת����ϵ�У������¡��á��ġ���Ϊ����һ����ͬԪ�ص��������ʡ�

������Ϊ����ɫ���嵥�ʣ���¡��ĵĻ�ѧ����ʽΪ_____________��
������������Ϊ���嵥�ʣ��ռ�����²��õķ���Ϊ________������32 gͭͶ���Թ����ģŵ�Ũ��Һ�У�������������Ϊ11.2 L(STP),�μӷ�Ӧ����������ʵ���Ϊ_____��
���𰸡� Fe��2H�� ��Fe2����H2�� ��2Na��2H2O=2Na����2OH����H2���� 2C��SiO2![]() Si��2CO �� Cl2��2KI= I2��2KCl�� ���� Fe��2Fe3��= 3Fe2�� SO2��H2O��SO32��=2HSO3�� ��CO2��H2O ��CO32��=2HCO3�� 2SO2��O2
Si��2CO �� Cl2��2KI= I2��2KCl�� ���� Fe��2Fe3��= 3Fe2�� SO2��H2O��SO32��=2HSO3�� ��CO2��H2O ��CO32��=2HCO3�� 2SO2��O2![]() 2SO3 ��ˮ�� 1.5 mol
2SO3 ��ˮ�� 1.5 mol
����������1���ٽ��������û����ǽ������ʵ����ӷ�Ӧ����ʽ������Fe��2H����Fe2����H2����2Na��2H2O=2Na����2OH����H2���ȣ��ڷǽ��������û����ǽ������ʵĻ�ѧ����ʽ������2C��SiO2![]() Si��2CO��Cl2��2KI=I2��2KCl�ȡ���2������Z��һ���ܹ���Ѫ�쵰����������ȱ�������壬��X��̼��a��������Y�Ƕ�����̼������X��һ�ֳ����������ʣ�����ת����ϵͼ��֪X�DZ�۽�������aΪһ�ֺ����ᣬ��a�����ᣬY����������Z���������������Yת��ΪZ�����ӷ���ʽΪFe��2Fe3��=3Fe2��������X��һ��ǿ�a��һ�������������a�Ƕ�������������̼��Z�����Σ�Y����ʽ�Σ�������ת��Ϊ�������ӷ�Ӧ����ʽΪSO2��H2O��SO32��=2HSO3����CO2��H2O��CO32��=2HCO3������3��������Ϊ����ɫ���嵥�ʣ�A�ǵ�����B��SO2��C��H2S��D��SO3��E��H2SO4�����������Ļ�ѧ����ʽΪ2SO2��O2
Si��2CO��Cl2��2KI=I2��2KCl�ȡ���2������Z��һ���ܹ���Ѫ�쵰����������ȱ�������壬��X��̼��a��������Y�Ƕ�����̼������X��һ�ֳ����������ʣ�����ת����ϵͼ��֪X�DZ�۽�������aΪһ�ֺ����ᣬ��a�����ᣬY����������Z���������������Yת��ΪZ�����ӷ���ʽΪFe��2Fe3��=3Fe2��������X��һ��ǿ�a��һ�������������a�Ƕ�������������̼��Z�����Σ�Y����ʽ�Σ�������ת��Ϊ�������ӷ�Ӧ����ʽΪSO2��H2O��SO32��=2HSO3����CO2��H2O��CO32��=2HCO3������3��������Ϊ����ɫ���嵥�ʣ�A�ǵ�����B��SO2��C��H2S��D��SO3��E��H2SO4�����������Ļ�ѧ����ʽΪ2SO2��O2![]() 2SO3��������������Ϊ���嵥�ʣ�A�ǵ�����B��NO��C��NH3��D��NO2��E��HNO3��NO������ˮ����������Ӧ�������ռ�����NO���õķ���Ϊ��ˮ����32gͭ�����ʵ�����0.5mol������0.5mol����ͭ�������Ե�������1mol����״����11.2L��������ʵ�����0.5mol�����ݵ�ԭ���غ��֪����ԭ��������0.5mol�����Բμӷ�Ӧ��������1.5mol��
2SO3��������������Ϊ���嵥�ʣ�A�ǵ�����B��NO��C��NH3��D��NO2��E��HNO3��NO������ˮ����������Ӧ�������ռ�����NO���õķ���Ϊ��ˮ����32gͭ�����ʵ�����0.5mol������0.5mol����ͭ�������Ե�������1mol����״����11.2L��������ʵ�����0.5mol�����ݵ�ԭ���غ��֪����ԭ��������0.5mol�����Բμӷ�Ӧ��������1.5mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л����˵����ȷ���ǣ� ��
A.���ࡢ��֬�������ʶ��Ǹ߷��ӻ�����
B.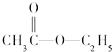 �� H
�� H ![]() O����ˮ�ⷴӦ�����ɵIJ�����18O�������Ҵ���
O����ˮ�ⷴӦ�����ɵIJ�����18O�������Ҵ���
C.��ȥ���������л��е����ᣬ���Լ����Ҵ���������
D.��֬����������������ˮ�ⶼ���ɱ����������ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����ڱ���ǰ�����ڵ�����Ԫ��A��B��C��D��E��F�˵����������������Aԭ�Ӻ���������δ�ɶԵ��ӣ�������B2E�ľ���Ϊ���Ӿ��壬Eԭ�Ӻ����M���������ԳɶԵ��ӣ�CԪ���ǵ��к�����ߵĽ���Ԫ�أ�D���ʵ��۵���ͬ����Ԫ���γɵĵ���������ߵģ�F2�����Ӻ��������Ӿ������������������Ϣ���ش��������⣺
��1��A��B��C��D�ĵ�һ��������С�����˳��Ϊ______����Ԫ�ط��ű�ʾ��
��2��B���Ȼ�����۵��D���Ȼ�����۵�ߣ�������______��
��3��E�������������ӵĿռ乹����______����______���ӣ�����ԡ����Ǽ��ԡ���
��4��Fԭ�ӵļ۲�����Ų�ʽ��_____��
��5��E��F�γ�ij�ֻ���������ͼ��ʾ���־���ṹ����ɫ���ʾFԭ�ӣ����仯ѧʽΪ_____����a����Eԭ�ӵ���λ��Ϊ______�����ڣ�b���Ľṹ��ȡ��һ��ƽ����������Ϊ��������ƽ��һ�������к���_____��Fԭ�ӡ��ṹ��a���루b���о�����ԭ�ӿռ���������ȣ���a��________��b�����>����<����=����
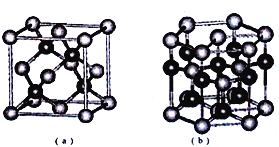
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����٤����������ֵ������������ȷ����
A. 78g���к��е�̼̼˫������ĿΪ3NA
B. 16gCu2S��CuO��ɵĻ�����к��е���������Ϊ0.2NA
C. ��1mol H2�� 1 mol I2����һ�ܱ������г�ַ�Ӧ��ת�Ƶĵ�����Ϊ2NA
D. 1 mol Fe ��������Ũ���Ṳ�ȷ�Ӧ������SO2�ķ�����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�ʾ��Ӧ��ѧ��Ӧ�����ӷ���ʽ��ȷ���ǣ� ��
A.���������ڴ�����Һ��C6H5O��+H+��C6H5OH
B.��ϡ�����ȥ�Թ��ڱ�����Ag+2H++NO3���TAg++NO2��+H2O
C.����ˮ�ⷴӦ��CH3CH2OOCCH3+H218O ![]() CH3CH2OH+CH3CO18OH
CH3CH2OH+CH3CO18OH
D.��ȩ��������Ӧ��CH3CHO+2Ag��NH3��2OH ![]() CH3COO��+NH4++2Ag��+3NH3+H2O
CH3COO��+NH4++2Ag��+3NH3+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ�������ж���ȷ����
A. 0.1 mol Na2O2���е���������Ϊ0.4NA
B. ���³�ѹ�£�18g H2O ������������Ϊ8NA
C. 5.6 g�����������ᷴӦת�Ƶĵ�����Ϊ0.3NA
D. ����0.l mol FeCl3�ı�����Һ�Ƴɽ���������ɵ�Fe(OH)3������ĿΪ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CeO2��һ����Ҫ��ϡ������������÷�̼�����Ҫ�ɷ�ΪCeFCO3�����Ʊ����乤���������£�

��֪��I.Ce4+����SO42-��ϳ�[CeSO4]2+����F-��ϳ�[CeFx]��4-x��+��0<x<4��.
II.��������ϵ�У�Ce4+�ܱ���ȡ����ȡ��Ce3+���ܡ�
�ش��������⣺
��1�����������ա��С���������Ŀ����_________________��
��2��CeO2������ˮ�ͼ�����ᣬ����������ʱȴ���ܽ���ȫ��ԭ������Һ�е�_______����ԭ�ӷ��ţ���ͬ����__________��_____________�ٽ���CeO2���ܽ⡣
��3��������ȡ��ʱ������Ӧ�����ӷ���ʽΪ____________________��
��4����ȱ�١�ϴ������һ���ڣ������ò�Ʒ��������___________���ƫ��ƫС�����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�����������ǣ� ��
A.����ʱ��Ӧʹ�¶ȼ�ˮ����������ƿ֧�ܿ�
B.��Һʱ����Һ©�����²�Һ����¿ڷų����ϲ�Һ����Ͽڵ���
C.��ȡ����Һǰ��Է�Һ©����©
D.�þƾ���ȡ��ˮ�еĵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮAlCl3(183 ������)����ʪ��������������������ʵ���ҿ�������װ���Ʊ���
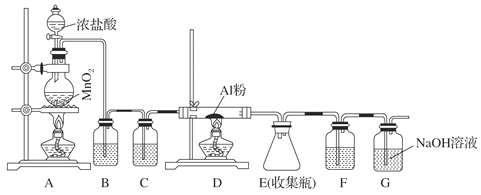
��1������װ��A�����Ʊ�������д�������ӷ�Ӧ����ʽ��_____________________________��
��2��װ��B��ʢ�ű���NaCl��Һ����װ�õ���Ҫ������_____________________________��
��3��GΪβ������װ�ã����з�Ӧ�Ļ�ѧ����ʽ��___________________________________��
��4���Ʊ������ķ�Ӧ��������Ũ���½���ֹͣ��Ϊ�ⶨ��Ӧ����Һ�������Ũ�ȣ�̽��С��ͬѧ�������ʵ�鷽����������AgNO3��Һ��Ӧ���������ɵ�AgCl�������˷���__________������С����������С�����˵������__________________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com