
【题目】如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
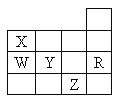
A. 常温常压下五种元素的单质中Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子相同
C. W的氢化物的热稳定性比X的氢化物的热稳定性高
D. Y元素的非金属性比W元素的非金属性强
科目:高中化学 来源: 题型:
【题目】下列水解反应离子方程式书写正确的是( )
A.CH3COOH+OH﹣CH3COO﹣+H2O
B.S2﹣+2H2OH2S+2OH﹣
C.CH3COOH+H2OCH3COO﹣+H3O+
D.CO32﹣+H2OHCO3﹣+OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还含有一定量的SiO2)可用于制备FeCO3,其流程如下:
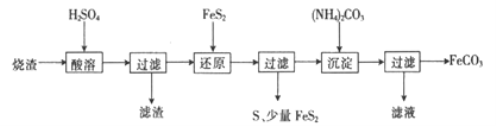
已知:还原时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应ⅠW为
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+。
(1)反应Ⅰ中还原剂是_________
(2)滤渣的成分是_______(填名称)。
(3)所得FeCO3需充分洗涤,检验FeCO3是否洗净的方法是____________
(4)①配平反应的离子方程式: ![]() ____________
____________
②还原前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
离子 | 离子浓度(mol/L) | |
还原前 | 还原后 | |
Fe2+ | 0.10 | 2.50 |
SO42- | 3.50 | 3.70 |
则反应Ⅰ、Ⅱ中生成Fe2+的物质的量之比为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,单质A、B、C分别为固体、黄绿色气体与无色气体,在合适条件下,它们可以按下面的流程进行反应.又知E溶液是无色的.请回答: 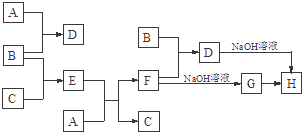
(1)写出E物质的化学式 .
(2)写出G→H的化学方程式 .
(3)写出B+F→D的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述中正确的是
A. 向NaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH=13
B. NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度不同
C. 向醋酸溶液中加少量水稀释, 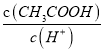 增大
增大
D. 向0.10mol/LNa2CO3溶液中通入少量CO2后:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 L 1 mol·L-1 Na2SO4溶液中,下列各量正确的是
A.c(Na+)=1 mol·L-1 B.n(Na+)=3 mol
C.c(SO42-)=2 mol·L-1 D.m(Na2SO4)=142 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1814年戴维发现了一氯化碘(沸点97.4℃),是一种红棕色易挥发液体,它的性质与卤素相似,可用作强氧化剂。干燥的氯气与碘反应可以制备ICl ,请用下列装置来制备ICl。

回答下列问题:
(1)制备ICl时,各装置接口的连接顺序是__________。
(2)能否将装置B 中的饱和食盐水换成水______(填“能”或“不能“);请用平衡移动的观点解释其理由________________。
(3)D装置中的烧瓶需放在冷水中,其目的是____________。
(4)将D装置得到的液态产物进步提纯可得到较纯净的IC1,提纯采取的方法是___________。
(5)ICl 与冷的NaOH稀溶液反应的离子方程式为______________。
(6)请设计实验证明IC1的氧化性比I2强:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学查阅教材得知,普通锌锰电池筒内无机物质主要成分为MnO2、NH4Cl、ZnCl2等物质。他在探究废干电池内的黑色固体回收利用时,进行如图所示实验:下列有关实验的叙述中,不正确的是

A. 操作①中玻璃棒的作用是加快固体溶解速度
B. 操作②的操作名称是过滤
C. 操作③中盛放药品的仪器是坩埚
D. 操作④的目的是除去滤渣中杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在③~⑦元素中,原子半径最大的是 , 其离子的原子结构示意图为
(2)写出⑤和⑨最高价氧化物对应水化物间发生反应的离子方程式: .
(3)按要求写出下列两种物质的电子式:①的单质;⑨的过氧化物;
(4)在⑦与⑩的单质中,化学性质较活泼的是 , 可用什么化学反应说明该事实(写出反应的化学方程式): .
(5)请用电子式表示④和⑩组成的化合物的形成过程 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com