
【题目】NA代表阿伏加德罗常数的值,下列有关叙述正确的是
A. 标准状况下,铁在22.4L氯气中完全燃烧时转移电子数为3NA
B. 1 L 0.1 mol·L1的NaHCO3溶液中![]() 和
和![]() 离子数之和为0.1NA
离子数之和为0.1NA
C. 在一定温度下64gSO2与足量氧气充分反应,转移电子数为4NA
D. 含有NA个Fe( OH)3胶粒的氢氧化铁胶体中,铁元素的质量大于56g
【答案】D
【解析】
A、铁在22.4L氯气中完全燃烧,氯气完全反应;
B、由物料守恒关系可知,1 L 0.1 mol·L1的NaHCO3溶液中HCO3—、CO32—和H2CO3之和为0.1mol;
C、二氧化硫与氧气生成三氧化硫的反应为可逆反应;
D、氢氧化铁胶体为氢氧化铁的聚集体;
A项、标准状况下,22.4L氯气的物质的量为1mol,铁在22.4L氯气中完全燃烧,1mol氯气完全反应,转移电子数为0.2NA,故A错误;
B项、由物料守恒关系可知,1 L 0.1 mol·L1的NaHCO3溶液中HCO3—、CO32—和H2CO3之和为0.1mol,则1 L 0.1 mol·L1的NaHCO3溶液中HCO3—和CO32—离子数之和小于0.1NA,故B错误;
C项、二氧化硫与氧气生成三氧化硫的反应为可逆反应,64gSO2的物质的量为1mol,反应生成的三氧化硫小于1mol,转移的电子小于2mol,故C错误;
D项、氢氧化铁胶体为氢氧化铁的聚集体,含有NA个Fe( OH)3胶粒的氢氧化铁胶体中,铁元素的物质的量大于1mol, 铁元素的质量大于56g,故D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】某实验需要物质的量浓度为0.5mol/L的NaOH溶液960mL用于酸碱中和实验,配制NaOH溶液的步骤如下,回答下列问题:
第一步:称取NaOH固体,加入适量蒸馏水溶解;
第二步:待冷却后转移至容量瓶中;
第三步:用蒸馏水洗涤烧杯和玻璃棒2~3次,将洗涤液也注入容量瓶中;
第四步:定容
第五步:摇匀。
(1)第一步中称量NaOH固体的质量为____g;
(2)第四步“定容”的具体操作为____;
(3)如果配制溶液过程中出现下列情况会对所配制的溶液物质的量浓度有何影响?(填“偏大”、“偏小”或“无影响”)
①容量瓶中原有少量蒸馏水___,
②定容时俯视观察____,
③把烧碱放在纸上称量____,
④溶解所用的烧杯未洗涤____;
(4)取所配溶液10mL于试管中,加入5mL某浓度的盐酸溶液恰好中和,则所加的盐酸溶液的物质的量浓度是____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米材料一直是人们研究的重要课题,例如纳米级Fe粉表面积大,具有超强的磁性,高效催化性等优良的性质。资料显示:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570℃时生成FeO,高于570℃时生成Fe3O4。如下两个装置可在不同温度下进行该反应并验证产物。
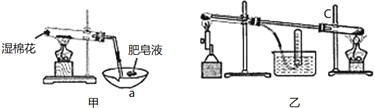
(1)甲装置中仪器a的名称为_____。
(2)装置甲验证气体产物的操作是____。装置C的作用是____。
(3)A同学取出少量乙装置中实验结束后的固体物质于另一试管中,加入少量盐酸,微热,观察到黑色粉末逐渐溶解,溶液呈浅绿色,有少量气泡产生。再向溶液中滴加几滴KSCN溶液,震荡,溶液没有出现红色,推断该条件下生成FeO,B同学却不同意该结论,他的理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以某种比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是
A. CH4、C2H4 B. CH4、C3H6 C. C2H4、C3H4 D. C2H2、C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)完全燃烧0.1 mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9 g,浓碱液增重17.6 g。该烃的化学式为____,并写出其所有可能的结构简式:________。
(2)某烃在O2中完全燃烧,生成6.6 g CO2和3.6 g H2O,在标准状态下该烃的密度为1.964 3 g·L1,则其化学式为_______。
(3)某烷烃的相对分子质量为128,该烷烃的化学式为_______。
(4)在120 ℃和101 kPa的条件下,某气态烃和一定质量的氧气的混合气体在点燃完全反应后再恢复到原来的温度时,气体体积缩小了,则该烃分子内的氢原子个数___(填序号)。
A.小于4 B.大于4 C.等于4 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】贝诺酯是一种新型抗炎、解热、镇痛药,其结构如下所示。下列对该化合物叙述正确的是

A. 贝诺酯分子式为![]()
B. 贝诺酯属于芳香烃
C. 贝诺酯属于高分子化合物
D. 已知贝诺酯的水解产物之一为对氨基乙酰酚( ),在核磁共振氢谱中,对氨基乙酰酚有5种峰
),在核磁共振氢谱中,对氨基乙酰酚有5种峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铅(PbCl2)常用于焊接和制备铅黄等染料。利用从废旧铅蓄电池中得到的铅膏获取氯化铅的流程如图,试回答下列问题:

已知:①铅膏主要由PbSO4、PbO、PbO2和Pb等组成。
②流程图中的“1”表示液体,“s”表示固体。
③硫酸铅、氯化铅微溶于水,但氯化铅能溶于NaCl溶液中,主要发生反应:PbCl2+Cl-==[PbCl3]-。
(1)铅蓄电池的正极材料是________________(填化学式),放电时负极的电极反应式为________。
(2)“浸取反应”是在加热条件下,用盐酸和氯化钠溶液浸取铅膏的过程,主要发生反应的方程式有PbP
PbO2+Pb+4HCl==2PbCl2+2H2O PbO+2HCl==PbCl2+H2O,
PbSO4+2NaCl==PbCl2+Na2SO4 PbCl2+Cl-=[PbCl3]-
除此之外,PbO2还能与HCl反应产生一种黄绿色气体,该反应的化学方程式是________________;该浸取过程中Pb与盐酸反应产生的H2可能会与________ (填气体名称,下同)、________等混合发生爆炸。
(3)PbCl2(溶液显酸性)在氯化钠溶液中的溶解度随温度的升高而增大,适当地升高温度有利于提高铅的浸取率,当温度高于70℃时,浸取率提高不明显,可能的原因是________________________________;为了提高浸取率,还可以采取的措施是________________________________________。
(4)在室温下静置冷却3h后,过滤得到的氯化铅的回收率可达到85%,过滤后得到的滤液进行循环使用可提高铅的利用率。在循环使用之前需加入氯化钙将SO42-进行沉淀转化,若无此步骤,直接循环使用,溶液中SO42-浓度过大,则会导致的结果是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体,但不能干燥有较强还原性的HI、H2S等气体
B. 浓硫酸与单质硫反应的化学方程式:S+2H2SO4(浓)![]() 3SO2↑+2H2O,在此反应中,浓硫酸既表现了强氧化性又表现了酸性
3SO2↑+2H2O,在此反应中,浓硫酸既表现了强氧化性又表现了酸性
C. 常温下能够用铁、铝等容器盛放浓H2SO4,是因为浓H2SO4的强氧化性使其钝化
D. 把足量铜粉投入到含2molH2SO4的浓硫酸中,得到气体体积在标准状况下为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. NH3和CH4的中心原子都是sp3杂化
B. 基态原子的核外电子排布为[Kr]4d105s1的元素属于d区
C. SO2和CO2都是直线形分子,其中心原子都是sp杂化
D. 电子由低能级跃迁至较高能级时,可通过光谱仪直接摄取原子的发射光谱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com