
| ||
| ||
| 1.56g |
| 78g/mol |
| 0.18mol |
| 0.5mol?L-1 |


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
| A、15:4 | B、1:1 |
| C、5:2 | D、3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、44 g CO2中含有2 mol C |
| B、O2的摩尔质量是32 g/mol |
| C、18 g H2O在标准状况下的体积是22.4 L |
| D、将58.5 g NaCl溶于1 L水中,所得溶液中NaCl的物质的量浓度为1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
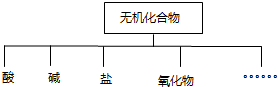
| 物质 类别 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
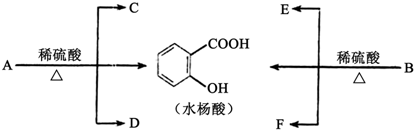
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原混合物中n(Fe):n(Fe2O3)=2:1 |
| B、向溶液中滴入KSCN溶液,显红色 |
| C、无法计算原混合物的质量a |
| D、此时溶液中Fe2+和Fe3+的物质的量之比为3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A元素在周期表中的位置是第六周期第ⅠA族 |
| B、单质A性质稳定 |
| C、A元素的最高价氧化物的水化物是一种强碱 |
| D、A有多种氧化物,但均不与水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑤ | B、②③⑤ |
| C、②③ | D、全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com