
【题目】在密闭容器中,对于可逆反应A+3B![]() 2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是( )
2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是( )

A. 若正反应方向ΔH<0,则T 1 >T 2
B. 压强增大时,混合气体的平均相对分子质量减小
C. B一定为气体
D. A一定为气体
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】下列物质的分子中既有σ键,又有π键的是
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2
A.①②③ B.③④⑤⑥ C.③⑤⑥ D.①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质量相等的两份气体样品,一份是CO,另一份是CO2,这两份气体样品中,CO与CO2所含氧原子的原子个数之比是 ( )
A. 1:2 B. 1:4 C. 11:14 D. 1l:28
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O
B. 清洁能源所用光电池的生产材料主要是用高纯度的二氧化硅
C. 在医疗上氢氧化铝可用于治疗胃酸过多
D. 漂白粉在使用时一定要加入一定量的盐酸才能起到漂白作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学及溶解沉淀的相关问题
(1)由下列物质冶炼相应金属时,采用电解法的是________(填字母,下同)。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的
是_________。
a.电能全部转化为化学能 b.粗铜接电源正极、发生氧化反应
c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属
e.若阳极质量减少64g,则转移电子数为2NA个 f. SO42-的物质的量浓度不变(不考虑溶液体积变化)
(3)以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为:______________。
(4)高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式为____________。
3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式为____________。
(5) 为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
步骤1:向2mL0.005mol·L-1AgNO3溶液中加入2mL0.005 mol·L-1KSCN溶液,静置 | 出现白色沉淀 |
步骤2:取1mL上层清液于试管中,滴加1 mol·L-1滴2Fe(OH3)3溶液。 | 溶液变为红色 |
步骤3:向步骤2的溶液中,继续加入5滴3 mol·L-1AgNO3溶液 | 现象a_____________, 溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1KI溶液 | 出现黄色沉淀。 |
已知:. AgSCN是白色沉淀。
Ⅱ. 相同温度下,Kap(AgI)=8.3×10-17,Kap(AgSCN)=1.0×10-12。
①步骤3中现象a是__________________。
②用沉淀溶解平衡原理解释步骤4的实验现象_________________。
③向50mL0.005 mol·L-1AgNO3溶液中加入150mL0.005 mol·L-1的KSCN溶液,混合后溶液中Ag+的浓度约为___________mol·L-1。(忽略溶液体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的用途,与盐类水解有关的是( )
A. 硫酸钡可做白色颜料 B. FeCl3用于印刷线路板
C. 热的纯碱溶液用于清洗油污 D. 氯化钠是氯碱工业的重要原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 在25℃时,将amol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数:Kb=![]()
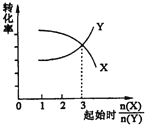
B. 在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应生成Z,平衡后测得X、Y的转化率与起始时两物质的物质的量之比n(X)/n(Y)的关系如图所示,则x与Y的反应方程式可表示为:X + 3Y ![]() nZ
nZ
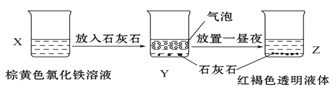
C. 某同学在实验室进行了如图所示的实验,则Y中反应的离子方程式为:3CaCO3+2Fe3++3H2O= 2Fe(OH)3+3CO2↑+3Ca2+
D. 将10mL 1 molL-1Na2CO3溶液逐滴滴加到10mL 1mol·L-1盐酸中,滴加结束后生成的溶液中有:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应又是离子反应的是
A. 用CO还原氧化铁来炼铁 B. 用锌和稀盐酸反应制氢气
C. 用稀硫酸除铁锈 D. CO2通入澄清石灰水变浑浊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com