
【题目】下列关于物质的用途,与盐类水解有关的是( )
A. 硫酸钡可做白色颜料 B. FeCl3用于印刷线路板
C. 热的纯碱溶液用于清洗油污 D. 氯化钠是氯碱工业的重要原料
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是

A. 两烧杯中铜片表面均无气泡产生
B. 甲中铜片是正极,乙中铜片是负极
C. 两烧杯中溶液的pH均增大
D. 甲、乙溶液均变蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,对于可逆反应A+3B![]() 2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是( )
2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是( )

A. 若正反应方向ΔH<0,则T 1 >T 2
B. 压强增大时,混合气体的平均相对分子质量减小
C. B一定为气体
D. A一定为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4P(红磷s)![]() P4(白磷s) △H = +17kJmol﹣1根据以上方程式,下列推论正确的是
P4(白磷s) △H = +17kJmol﹣1根据以上方程式,下列推论正确的是
A. 正反应是一个放热反应
B. 当lmol白磷完全转变成红磷时放出17kJ热量
C. 当4g红磷转变成白磷时吸收17kJ热量
D. 白磷比红磷稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过氧化钠加入到氯化亚铁溶液中,最终可以观察到的现象是( )
A. 过氧化钠将溶液漂白 B. 生成红褐色沉淀
C. 除溶解外无特殊现象产生 D. 生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
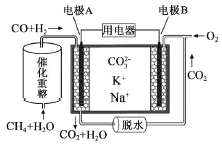
A. 电极A为正极
B. 电池工作时,CO32-向电极B移动
C. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将_____________还原(填离子符号)以便固体溶解。该步反应的离子方程式为 (写一个)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,氯元素被还原为最低价。该反应的离子方程式为 。
(3)利用平衡移动原理分析:加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是 。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是 ;使用萃取剂适宜的pH=____(填序号)左右:

A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com