
ЁОЬтФПЁПЕчЛЏбЇМАШмНтГСЕэЕФЯрЙиЮЪЬт
(1)гЩЯТСаЮяжЪвБСЖЯргІН№ЪєЪБЃЌВЩгУЕчНтЗЈЕФЪЧ________ЃЈЬюзжФИЃЌЯТЭЌЃЉЁЃ
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)CuSO4ШмвКЮЊЕчНтжЪШмвКНјааДжЭ(КЌAlЁЂZnЁЂAgЁЂPtЁЂAuЕШдгжЪ)ЕФЕчНтОЋСЖЃЌЯТСаЫЕЗЈе§ШЗЕФ
ЪЧ_________ЁЃ
a.ЕчФмШЋВПзЊЛЏЮЊЛЏбЇФм b.ДжЭНгЕчдДе§МЋЁЂЗЂЩњбѕЛЏЗДгІ
c.ШмвКжаCu2+ЯђбєМЋвЦЖЏ d.РћгУбєМЋФрПЩЛиЪеAgЁЂPtЁЂAuЕШН№Ъє
e.ШєбєМЋжЪСПМѕЩй64gЃЌдђзЊвЦЕчзгЪ§ЮЊ2NAИі f. SO42-ЕФЮяжЪЕФСПХЈЖШВЛБф(ВЛПМТЧШмвКЬхЛ§БфЛЏ)
(3)вдТСВФЮЊбєМЋЃЌдкH2SO4ШмвКжаЕчНтЃЌТСВФБэУцаЮГЩбѕЛЏФЄЃЌбєМЋЕчМЋЗДгІЪНЮЊЃК______________ЁЃ
(4)ИпЬњЕчГиЕФзмЗДгІЮЊ3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOHЃЌИУЕчГиЗХЕчЪБе§МЋЗДгІЪНЮЊ____________ЁЃ
3Zn(OH)2+2Fe(OH)3+4KOHЃЌИУЕчГиЗХЕчЪБе§МЋЗДгІЪНЮЊ____________ЁЃ
(5) ЮЊСЫбаОПФбШмбЮЕФГСЕэШмНтЦНКтКЭГСЕэзЊЛЏЃЌФГЭЌбЇЩшМЦШчЯТЪЕбщЁЃ
ВНжш1ЃКЯђ2mL0.005molЁЄL-1AgNO3ШмвКжаМгШы2mL0.005 molЁЄL-1KSCNШмвКЃЌОВжУ | ГіЯжАзЩЋГСЕэ |
ВНжш2ЃКШЁ1mLЩЯВуЧхвКгкЪдЙмжаЃЌЕЮМг1 molЁЄL-1ЕЮ2Fe(OH3)3ШмвКЁЃ | ШмвКБфЮЊКьЩЋ |
ВНжш3ЃКЯђВНжш2ЕФШмвКжаЃЌМЬајМгШы5ЕЮ3 molЁЄL-1AgNO3ШмвК | ЯжЯѓa_____________ЃЌ ШмвККьЩЋБфЧГЁЃ |
ВНжш4ЃКЯђВНжш1грЯТЕФзЧвКжаМгШы5ЕЮ3 molЁЄL-1KIШмвК | ГіЯжЛЦЩЋГСЕэЁЃ |
вбжЊЃК. AgSCNЪЧАзЩЋГСЕэЁЃ
Ђђ. ЯрЭЌЮТЖШЯТЃЌKap(AgI)=8.3ЁС10-17ЃЌKap(AgSCN)=1.0ЁС10-12ЁЃ
ЂйВНжш3жаЯжЯѓaЪЧ__________________ЁЃ
ЂкгУГСЕэШмНтЦНКтдРэНтЪЭВНжш4ЕФЪЕбщЯжЯѓ_________________ЁЃ
ЂлЯђ50mL0.005 molЁЄL-1AgNO3ШмвКжаМгШы150mL0.005 molЁЄL-1ЕФKSCNШмвКЃЌЛьКЯКѓШмвКжаAg+ЕФХЈЖШдМЮЊ___________molЁЄL-1ЁЃЃЈКіТдШмвКЬхЛ§БфЛЏЃЉ
ЁОД№АИЁП bd bdf 2Al+3H2O-6e-ЈTAl2O3+6H+ FeO42-+3e-+4H2OЈTFe(OH)3+5OH- ГіЯжАзЩЋГСЕэ вђЮЊгаAgSCN(s) ![]() Ag+(aq)+SCN-(aq)ЦНКтЃЌМгШыKIКѓЃЌвдвђШмНтЖШЃКAgSCN>AgIЃЌAg+гыI-ЗДгІЩњГЩAgIЛЦЩЋГСЕэЃЌAgSCNЕФШмНтЦНКте§ЯђвЦЖЏ 4ЁС10-10
Ag+(aq)+SCN-(aq)ЦНКтЃЌМгШыKIКѓЃЌвдвђШмНтЖШЃКAgSCN>AgIЃЌAg+гыI-ЗДгІЩњГЩAgIЛЦЩЋГСЕэЃЌAgSCNЕФШмНтЦНКте§ЯђвЦЖЏ 4ЁС10-10
ЁОНтЮіЁПЃЈ1ЃЉБОЬтПМВщН№ЪєвБСЖЕФЗНЗЈЃЌВЩгУЕчНтЗЈвЛАуЪЧЛюЦУН№ЪєЃЌЪЧKЁЋAlЃЌЙЪbdе§ШЗЃЛЃЈ2ЃЉПМВщДжЭЕФОЋСЖЃЌaЁЂЕчНтЙ§ГЬЪЧЕчФмзЊЛЏГЩЛЏбЇФмЃЌЕЋВЛЪЧШЋВПзЊЛЏЃЌвЛВПЗжзЊЛЏГЩШШФмЃЌЙЪaДэЮѓЃЛbЁЂИљОнЕчНтдРэЃЌДжЭгІгкЕчдДе§МЋЯрСЌЃЌДПЭгІгкЕчдДЕФИКМЋЯрСЌЃЌбєМЋЩЯЪЇШЅЕчзгЃЌЛЏКЯМлЩ§ИпЃЌЗЂЩњбѕЛЏЗДгІЃЌЙЪbе§ШЗЃЛcЁЂИљОнЕчНтдРэЃЌбєРызгЯђвѕМЋвЦЖЏЃЌЙЪcДэЮѓЃЛdЁЂДжЭжаКЌгаAgЁЂPtЕШЛюЖЏадБШЭШѕЕФН№ЪєЃЌзїЮЊГСЕэГСНЕГіРДЃЌЙЪdе§ШЗЃЛeЁЂДжЭжаКЌгаБШЭЛюЦУЕФН№ЪєЃЌШчаПЁЂЬњЕШЃЌЫќУЧЯШЪЇЕчзгЃЌвђДЫбєМЋжЪСПМѕЩй64gЃЌдђзЊвЦЕчзгЮяжЪЕФСПВЛЕШгк2molЃЌЙЪeДэЮѓЃЛfЁЂSO42ЃВЛВЮгыЗХЕчЃЌвђДЫХЈЖШЛљБОБЃГжВЛБфЃЌЙЪfе§ШЗЃЛЃЈ3ЃЉПМВщЕчНтдРэКЭЕчМЋЗДгІЪНЕФЪщаДЃЌЛюЖЏадН№ЪєзїбєМЋЃЌЯШЪЇЕчзгЃЌзЊЛЏГЩбѕЛЏТСЃЌМД2AlЃ6eЃЁњAl2O3ЃЌЛЗОГЪЧЫсадЃЌЧввЊЗћКЯЕчКЩЪиКуЃЌвђДЫЕчМЋЗДгІЪНЮЊ2AlЃ6eЃЃЋ3H2O=Al2O3ЃЋ6HЃЋЃЛЃЈ4ЃЉПМВщЕчГиЕчМЋЗДгІЪНЕФЪщаДЃЌе§МЋЩЯЛЏКЯМлНЕЕЭЃЌЗЂЩњЛЙдЗДгІЃЌИљОнЕчГиЗДгІЃЌе§МЋЗДгІЪНЮЊFeO42Ѓ+3eЃ+4H2OЈTFe(OH)3+5OHЃ ЃЛЃЈ5ЃЉПМВщГСЕэЕФШмНтЦНКтКЭГСЕэзЊЛЏЃЌвдМАШмЖШЛ§ЕФМЦЫуЃЌЂйИљОнВНжш1ЃЌAgЃЋКЭSCNЃЧЁКУЭъШЋЗДгІЃЌЩњГЩAgSCNЁ§ЃЌВНжш2жаШЁЩЯВуЧхвКЃЌМгШыFe(OH)3ЃЌШмвКБфКьЃЌЫЕУїЩЯВуЧхвКжаКЌгаSCNЃЃЌAgSCNШмНтЃЌЧвFe(OH)3ГСЕэЩйСПШмНтЩњГЩFe3ЃЋКЭOHЃЃЌШЛКѓFe3ЃЋЃЋ3SCNЃ![]() Fe(SCN)3ЃЌВНжш3жаМгШыAgNO3ШмвКЃЌAgЃЋНсКЯSCNЃЩњГЩAgSCNЁ§ЃЌДйЪЙЦНКтЯђФцЗДгІЗНЯђвЦЖЏЃЌШмвКбеЩЋБфЧГЃЛЂквђЮЊгаAgSCN(s)
Fe(SCN)3ЃЌВНжш3жаМгШыAgNO3ШмвКЃЌAgЃЋНсКЯSCNЃЩњГЩAgSCNЁ§ЃЌДйЪЙЦНКтЯђФцЗДгІЗНЯђвЦЖЏЃЌШмвКбеЩЋБфЧГЃЛЂквђЮЊгаAgSCN(s) ![]() Ag+(aq)+SCN-(aq)ЦНКтЃЌМгШыKIКѓЃЌИљОнШмЖШЛ§ЕФДѓаЁЃЌKsp(AgSCN)>Ksp(AgI)ЃЌЫЕУїAgIБШAgSCNИќФбШмЃЌAg+гыI-ЗДгІЩњГЩAgIЛЦЩЋГСЕэЃЌAgSCNЕФШмНтЦНКте§ЯђвЦЖЏЃЛЂлЗЂЩњAgЃЋSCNЃ=AgSCNЁ§ЃЌИљОнРызгЗНГЬЪНЃЌKSCNЙ§СПЃЌЗДгІКѓn(KSCN)=(150Ѓ50)ЁС10Ѓ3ЁС0.005mol=5ЁС10Ѓ4molЃЌЦфХЈЖШЮЊc(SCNЃ)=5ЁС10Ѓ4/200ЁС10Ѓ3molЁЄLЃ1=0.0025molЁЄLЃ1ЃЌИљОнKsp(AgSCN)=c(AgЃЋ)ЁСc(SCNЃ)ЃЌНтЕУc(AgЃЋ)=Ksp(AgSCN)/c(SCNЃ)=1ЁС10Ѓ12/0.0025molЁЄLЃ1=4ЁС10Ѓ10molЁЄLЃ1ЁЃ
Ag+(aq)+SCN-(aq)ЦНКтЃЌМгШыKIКѓЃЌИљОнШмЖШЛ§ЕФДѓаЁЃЌKsp(AgSCN)>Ksp(AgI)ЃЌЫЕУїAgIБШAgSCNИќФбШмЃЌAg+гыI-ЗДгІЩњГЩAgIЛЦЩЋГСЕэЃЌAgSCNЕФШмНтЦНКте§ЯђвЦЖЏЃЛЂлЗЂЩњAgЃЋSCNЃ=AgSCNЁ§ЃЌИљОнРызгЗНГЬЪНЃЌKSCNЙ§СПЃЌЗДгІКѓn(KSCN)=(150Ѓ50)ЁС10Ѓ3ЁС0.005mol=5ЁС10Ѓ4molЃЌЦфХЈЖШЮЊc(SCNЃ)=5ЁС10Ѓ4/200ЁС10Ѓ3molЁЄLЃ1=0.0025molЁЄLЃ1ЃЌИљОнKsp(AgSCN)=c(AgЃЋ)ЁСc(SCNЃ)ЃЌНтЕУc(AgЃЋ)=Ksp(AgSCN)/c(SCNЃ)=1ЁС10Ѓ12/0.0025molЁЄLЃ1=4ЁС10Ѓ10molЁЄLЃ1ЁЃ


 дФЖСПьГЕЯЕСаД№АИ
дФЖСПьГЕЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаБфЛЏжаЃЌашвЊЦЦЛЕРызгМќЕФЪЧ(ЁЁЁЁ)
A. ИЩБљЦјЛЏB. ТШЛЏЧтШмгкЫЎ
C. ЫЎЭЈЕчЗжНтГЩЧтЦјКЭбѕЦјD. МгШШЪЙТШЛЏФЦШлЛЏ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЕЊМАЦфЛЏКЯЮядкЙЄХЉвЕЩњВњжаОпгаживЊзїгУЁЃ
ЭъГЩЯТСаЬюПеЃК

ЃЈ1ЃЉШчЭМЫљЪОЮЊдЊЫижмЦкБэжаЕЊдЊЫиВПЗжаХЯЂЃЌЪ§ОнЁА14.01ЁББэЪОЕФЪЧ____________ЃЛЕЊдзгзюЭтВуЕчзгга________жжВЛЭЌЕФФмСПЃЌга_______жжВЛЭЌдЫЖЏзДЬЌЁЃ
ЃЈ2ЃЉNH3ПЩвдзїжЦРфМСЃЌЪЧвђЮЊ________________NH4ClШмвКгыNaOHШмвКЛьКЯжСжаадЃЌдђcЃЈNa+ЃЉ_______cЃЈNH3H2OЃЉЃЈЬюЁА<ЃЌ>ЁБЛђЁА=ЁБЃЉ
ЃЈ3ЃЉаДГівЛИіФмБШНЯЕЊЁЂбѕСНжждЊЫиЗЧН№ЪєадЧПШѕЕФЪТЪЕЃК________________
баОПNO2ЁЂSO2ЁЂCOЕШДѓЦјЮлШОЮяЕФДІРэОпгаживЊвтвхЁЃNO2ПЩгУЯТСаЗДгІРДДІРэЃК
![]()
ЃЈ4ЃЉаДГіЩЯЪіЗДгІЕФЦНКтГЃЪ§БэДяЪН_______________діДѓИУЗДгІЦНКтГЃЪ§ЕФДыЪЉга__________ЃЈЬюБрКХЃЉ
A. дібЙ B. діМгNH3ЕФХЈЖШ C. НЕЮТ D. МАЪБвЦзпВњЮя
ЃЈ5ЃЉвЛЖЈЬѕМўЯТЩЯЪіЗДгІдкФГЬхЛ§ЙЬЖЈЕФУмБеШнЦїжаНјааЃЌФмЫЕУїИУЗДгІвбОДяЕНЦНКтзДЬЌЕФЪЧ__________ЁЃЃЈЬюБрКХЃЉ
A. c(NO2) : c(NH3)=3:4 B. ![]()
![]()
C. ШнЦїФкЦјЬхзмбЙЧПВЛдйБфЛЏ D. ШнЦїФкЦјЬхУмЖШВЛдйБфЛЏ
ЃЈ6ЃЉФГЮТЖШЯТЃЌдквЛИіШнЛ§ЮЊ2Щ§ЕФЗДгІШнЦїФкЃЌЩЯЪіЗДгІ2ЗжжгКѓДяЕНЦНКтЃЌВтЪдNO2МѕЩйСЫ0.75molЃЌдђдк2ЗжжгФкNH3ЕФЦНОљЗДгІЫйТЪЮЊЃК ![]() =_____________
=_____________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЋДПаПЦЌКЭДПЭЦЌАДЭМЗНЪНВхШыЭЌХЈЖШЕФЯЁСђЫсжавЛЖЮЪБМфЃЌвдЯТа№Ъіе§ШЗЕФЪЧ

A. СНЩеБжаЭЦЌБэУцОљЮоЦјХнВњЩњ
B. МзжаЭЦЌЪЧе§МЋЃЌввжаЭЦЌЪЧИКМЋ
C. СНЩеБжаШмвКЕФpHОљдіДѓ
D. МзЁЂввШмвКОљБфРЖЩЋ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЙигкБН(ЯТЭМЫљЪО)ЕФа№Ъіе§ШЗЕФЪЧЃЈ ЃЉ

A. ЗДгІЂкВЛЗЂЩњЃЌЕЋЪЧШдгаЗжВуЯжЯѓЃЌзЯЩЋВудкЯТВу
B. ЗДгІЂйГЃЮТЯТФмНјааЃЌЦфгаЛњВњЮяЮЊ![]()
C. ЗДгІЂлЮЊМгГЩЗДгІЃЌВњЮяЪЧШ§ЯѕЛљМзБН
D. ЗДгІЂмжа1molБНзюЖргы3 mol H2ЗЂЩњМгГЩЗДгІЃЌЪЧвђЮЊБНЗжзгКЌгаШ§ИіЬМЬМЫЋМќ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкУмБеШнЦїжаЃЌЖдгкПЩФцЗДгІA+3B![]() 2CЃЈЦјЃЉЃЌЦНКтЪБCЕФЬхЛ§ЗжЪ§гыЮТЖШКЭбЙЧПЕФЙиЯЕШчЭМЫљЪОЃЌЯТСаХаЖЯе§ШЗЕФЪЧЃЈ ЃЉ
2CЃЈЦјЃЉЃЌЦНКтЪБCЕФЬхЛ§ЗжЪ§гыЮТЖШКЭбЙЧПЕФЙиЯЕШчЭМЫљЪОЃЌЯТСаХаЖЯе§ШЗЕФЪЧЃЈ ЃЉ

A. Шєе§ЗДгІЗНЯђІЄHЃМ0ЃЌдђT 1 ЃОT 2
B. бЙЧПдіДѓЪБЃЌЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПМѕаЁ
C. BвЛЖЈЮЊЦјЬх
D. AвЛЖЈЮЊЦјЬх
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП4PЃЈКьСзsЃЉ![]() P4ЃЈАзСзsЃЉ ЁїH = +17kJmolЉ1ИљОнвдЩЯЗНГЬЪНЃЌЯТСаЭЦТле§ШЗЕФЪЧ
P4ЃЈАзСзsЃЉ ЁїH = +17kJmolЉ1ИљОнвдЩЯЗНГЬЪНЃЌЯТСаЭЦТле§ШЗЕФЪЧ
A. е§ЗДгІЪЧвЛИіЗХШШЗДгІ
B. ЕБlmolАзСзЭъШЋзЊБфГЩКьСзЪБЗХГі17kJШШСП
C. ЕБ4gКьСззЊБфГЩАзСзЪБЮќЪе17kJШШСП
D. АзСзБШКьСзЮШЖЈ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГжжШлШкЬМЫсбЮШМСЯЕчГидРэЪОвтШчЭМЁЃЯТСагаЙиИУЕчГиЕФЫЕЗЈе§ШЗЕФЪЧ
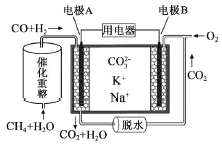
A. ЕчМЋAЮЊе§МЋ
B. ЕчГиЙЄзїЪБЃЌCO32-ЯђЕчМЋBвЦЖЏ
C. ЕчМЋAЩЯH2ВЮгыЕФЕчМЋЗДгІЮЊЃКH2+2OH--2e-=2H2O
D. ЕчМЋBЩЯЗЂЩњЕФЕчМЋЗДгІЮЊЃКO2+2CO2+4e-=2CO32-
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЯжЯѓгыбѕЛЏЛЙдЗДгІЮоЙиЕФЪЧ
AЃЎТСдкПеЦјжаЩњГЩжТУмЕФбѕЛЏФЄ
BЃЎРзгъЗЪзЏМк
CЃЎНЋЬњЦЌЗХШыCuSO4ШмвКжаЃЌЬњЦЌБэУцгаКьЩЋЮяжЪГіЯж
DЃЎЯђЙшЫсФЦШмвКжаЕЮМгЪЪСПЕФЯЁбЮЫсЃЌгаЭИУїЕФФ§НКаЮГЩ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com