
【题目】下列变化中,需要破坏离子键的是( )
A. 干冰气化B. 氯化氢溶于水
C. 水通电分解成氢气和氧气D. 加热使氯化钠熔化
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 都为短周期元素,A 是相对原子质量最小的元素;B 的+1 价阳离子和 C 的—1 价阴离子都与氖原子具有相同的电子层结构;D 在 C 的下一周期,可与 B 形成 BD 型离子化合物;E 和 C 为同一周期元素,其最高价氧化物对应的水化物为一种强酸。请根据以上信息回答下列问题。
(1)B 元素在元素周期表中的位置是第______周期______族。
(2)画出 D 元素的原子结构示意图____________。
(3)与 E 的氢化物分子所含电子总数相等的分子是 ____________(举一例、填化学式,下同 )、离子是____________。
(4)A 与 C 形成的化合物中含有化学键的类型是____________。
(5)D的单质与B的最高价氧化物对应的水化物的溶液发生反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,可逆反应mA(g)+nB(g)![]() pC(g)的平衡常数为K,下列对K的说法正确的是( )
pC(g)的平衡常数为K,下列对K的说法正确的是( )
A. 如果m+n=p,则K=1 B. 若缩小反应器的容积,能使平衡正向移动,则K增大
C. 温度越高,K一定越大 D. K值越大,表明该反应越有利于C的生成,反应物的转化率越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A.氧化还原反应的本质是元素化合价发生了变化
B.含化合价升高元素的反应物被氧化
C.得到电子的物质被氧化
D.氧化还原反应中,氧化剂和还原剂一定是两种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年,科学家们发明了一种能够给电子设备提供动力的生物燃料电池.该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中.由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示.下列说法正确的是

A. 左边为该电池的负极
B. 该电池可在高温环境下使用
C. 该电池负极反应为:H2-2e-=2H+
D. 该电池正极反应为O2+4e-=2O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分子中既有σ键,又有π键的是
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2
A.①②③ B.③④⑤⑥ C.③⑤⑥ D.①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A—表示乳酸根离子)。下列说法正确的是( )
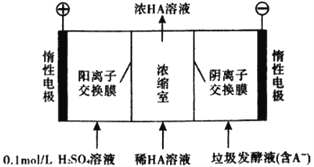
A. 通电后,阳极附近pH增大
B. 电子从负极经电解质溶液回到正极
C. 通电后,A—通过阴离子交换膜从阴极进入浓缩室
D. 当电路中通过2 mol电子的电量时,会有1 mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 60gSiO2中含Si-O键的个数为4NA
B. 1molNa2O2晶体中阴离子与阳离子之比为1:1
C. 1molSi晶体中含有4molSi-Si键
D. 12g金刚石中含有C-C键的个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学及溶解沉淀的相关问题
(1)由下列物质冶炼相应金属时,采用电解法的是________(填字母,下同)。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的
是_________。
a.电能全部转化为化学能 b.粗铜接电源正极、发生氧化反应
c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属
e.若阳极质量减少64g,则转移电子数为2NA个 f. SO42-的物质的量浓度不变(不考虑溶液体积变化)
(3)以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为:______________。
(4)高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式为____________。
3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式为____________。
(5) 为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
步骤1:向2mL0.005mol·L-1AgNO3溶液中加入2mL0.005 mol·L-1KSCN溶液,静置 | 出现白色沉淀 |
步骤2:取1mL上层清液于试管中,滴加1 mol·L-1滴2Fe(OH3)3溶液。 | 溶液变为红色 |
步骤3:向步骤2的溶液中,继续加入5滴3 mol·L-1AgNO3溶液 | 现象a_____________, 溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1KI溶液 | 出现黄色沉淀。 |
已知:. AgSCN是白色沉淀。
Ⅱ. 相同温度下,Kap(AgI)=8.3×10-17,Kap(AgSCN)=1.0×10-12。
①步骤3中现象a是__________________。
②用沉淀溶解平衡原理解释步骤4的实验现象_________________。
③向50mL0.005 mol·L-1AgNO3溶液中加入150mL0.005 mol·L-1的KSCN溶液,混合后溶液中Ag+的浓度约为___________mol·L-1。(忽略溶液体积变化)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com