
【题目】硒和碲的单质是重要的高新技术材料。一种以含贵重金属的“酸泥”(含Se、Te、Ag、Pb、Cu等单质)为原料制备硒和碲的工艺流程如图所示。
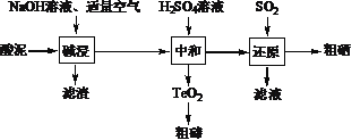
已知:①H2SeO3易溶于水,TeO2不溶于水。
②“中和”过程中测得不同pH下相关数据如下表:
“中和”终点pH | 滤液/(g·L-1) | 沉淀率/% | ||
Se | Te | Se | Te | |
4 | 11.2 | 0.029 | 8.9 | 98.1 |
5 | 13.7 | 0.01 | 5.8 | 98.9 |
6 | 12.4 | 0.013 | 4.1 | 91.6 |
回答下列问题:
(1)已知“碱浸”过程中生成了Na2SeO3和Na2TeO3,则“滤渣”中含有Cu和__。写出Se参加反应的离子方程式____。
(2)“碱浸”过程中通入空气应适量的原因是___。
(3)“中和”过程中生成TeO2的化学方程式是____。
(4)“中和”终点pH应选择在____附近,原因是___。
(5)“滤液”可返回____工序循环使用。
(6)要制取395g粗硒(质量分数为80%),理论上至少应通入标准状况下的SO2____L。
【答案】Ag、Pb Se+2OH-+O2=SeO32-+H2O 过量空气会将Na2TeO3、Na2SeO3氧化 Na2TeO3+H2SO4= Na2SO4+TeO2↓+H2O 5 滤液中Se浓度高,损失少,且Te沉淀率高 中和 179.2
【解析】
由流程知:“酸泥”(含Se、Te、Ag、Pb、Cu等单质)中Se、Te 经过“碱浸”过程被氧化生成了Na2SeO3和Na2TeO3,Ag、Pb、Cu不反应,过滤以后得到的溶液含过量的碱、Na2SeO3和Na2TeO3,“中和”过程中在一定pH下,Na2SeO3和Na2TeO3分别转化为易溶于水的H2SeO3、不溶于水的TeO2,经过滤,把二氧化硫通入滤液中把H2SeO3还原为Se,据此回答;
(1)“碱浸”过程中只有Se、Te被空气中的氧气氧化,生成了可溶性的Na2SeO3和Na2TeO3进入溶液,而Ag、Pb、Cu不反应,则“滤渣”中含有Ag、Pb、Cu;Se参加反应的离子方程式为:Se+2OH-+O2=SeO32-+H2O;
答案为:Ag、Pb;Se+2OH-+O2=SeO32-+H2O;
(2)Se、Te 都位于第ⅥA族,Na2SeO3中的Se和Na2TeO3中的Te都呈+4价,Na2SeO3和Na2TeO3既有氧化性又有还原性,若“碱浸”过程中通入空气过量,则过量空气会将Na2TeO3、Na2SeO3氧化;
答案为:过量空气会将Na2TeO3、Na2SeO3氧化;
(3)“中和”过程中,硫酸和Na2TeO3反应生成硫酸钠、水和TeO2,化学方程式为:Na2TeO3+H2SO4= Na2SO4+TeO2↓+H2O;
答案为:Na2TeO3+H2SO4= Na2SO4+TeO2↓+H2O;
(4)从流程图知,“中和”是分离Se、Te元素的环节,根据中和”过程中测得不同pH下相关的数据知,终点pH应选择在5附近,原因是滤液中Se浓度高,损失少,且Te沉淀率高;
答案为:5;滤液中Se浓度高,损失少,且Te沉淀率高;
(5)“还原”过程是二氧化硫通入滤液中把H2SeO3还原为Se,二氧化硫被氧化生成硫酸,故 “滤液”中含硫酸,可返回中和工序循环使用;
答案为:中和;
(6)二氧化硫通入滤液中把H2SeO3还原为Se的反应为:![]() ,
, ,则
,则![]() =
=![]() ,解得V=179.2L;
,解得V=179.2L;
答案为:179.2L。


科目:高中化学 来源: 题型:
【题目】1mol过氧化钠与1.6mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是 ( )
A. Na2CO3 B. NaOH、Na2CO3 C. Na2O2、 Na2CO3 D. Na2O2、 NaOH 、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法适合实验室制取氨气的是( )
A.N2和H2催化加热制取氨气
B.加热NH4Cl制取氨气
C.将浓氨水加入到碱石灰固体中
D.将NH4Cl溶液和NaOH溶液混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,我国北京等地出现严重雾霾天气,据研究,雾霾的形成与汽车排放的 CO、 NO2 等有毒气体有关,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气 体,反 应方程式为4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g)ΔH=-1200kJ/mol。对于该反应, 温度不同(T2 > T1 )其他条件相同时,下列图像正确的是
4CO2(g)+N2(g)ΔH=-1200kJ/mol。对于该反应, 温度不同(T2 > T1 )其他条件相同时,下列图像正确的是

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种银白色的过渡金属,有良好的抗腐蚀性,是强度重量比最高的金属。请回答下列问题:
⑴基态钛原子核外共有_____个填充了电子的原子轨道,其外围电子的轨道表达式为_____。
⑵金属钛有两种同素异形体。
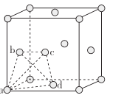
①在较高温度时具有体心立方晶胞,其空间利用率为_______(用含π的式子表示)。
②在较低温度时,采用面心立方最密堆积,其晶胞中有若干个正四面体空隙(如下图中a、b、c、d四个钛原子形成一个正四面体,其内部为正四面体空隙),可以填充其他原子。若晶胞中所有的正四面体空隙中都填充1个氢原子,则形成的氢化钛的化学式为________。
⑶金属钛的熔点、硬度均比铝大,可能的原因是_______。
⑷TiCl4是氯化法制取钛的中间产物。TiCl4和SiCl4在常温下都是液体,分子结构相同。采用蒸馏的方法分离TiCl4和SiCl4的混合物,先获得的馏分是_______(填化学式)。
⑸有机合成中某种含钛催化剂的结构如图所示。
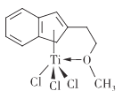
①组成该催化剂的元素中,电负性最大的是____(填元素名称)。
②该催化剂中碳原子的杂化方式为_____。
⑹配合物[TiCl(H2O)5]Cl2的配位数是__, 向含1 mol该配合物的水溶液中加入足量AgNO3溶液,可生成AgCl沉淀的物质的量为__。
⑺腈化钛(TiCN)可用于制备空气净化材料,已知氰气分子[(CN)2]中所有原子均满足最外层8电子稳定结构,则氰气分子中σ键和π键的个数比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的每一方格表示相关的一种反应物或生成物。其中B是一种单质,其余物质也都是含有B元素的化合物。C是一种钠盐,E是C对应的酸,B的结构类似金刚石,D为氧化物。
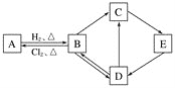
请回答下列问题:
(1)A、D、E的化学式分别为________、________、________。
(2)A和B的互相转化在工业上有什么实际意义?_____________________。
(3)写出D→C反应的化学方程式:_____________________。
(4)写出E→D反应的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述中,正确的是( )
A. 含20.0gNaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-114.8kJ·mol-1
B. 已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
C. 已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1,则H2的燃烧热为241.8kJ·mol-1
D. 已知石墨转化为金刚石为吸热,那么石墨比金刚石稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知CH3OH(l)的燃烧热ΔH=-238.6kJ/mol,CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-a kJ/mol,则a________238.6(填“>”、“<”或“=”)。
(2)反应mA(g)+nB(g)![]() pC(g)+qD(g)过程中的能量变化如图所示,回答下列问题。
pC(g)+qD(g)过程中的能量变化如图所示,回答下列问题。
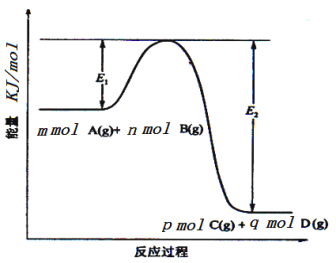
该反应ΔH=_____________________(用含E1、E2式子表示);在反应体系中加入催化剂,E1___________,E2___________(填增大、减小、不变)。
(3)已知常温时红磷比白磷稳定,已知:
①P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1
②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2
比较反应中ΔH的大小:ΔH1_______ΔH2(填“>”、“<”或“=”)。
(4)已知:稀溶液中,H+(aq)+OH(aq)=H2O(l) ΔH=﹣57.3 kJ![]() ,则浓硫酸与稀氢氧化钠溶液反应生成1mol水,放出的热量________57.3 kJ(填“>”、“<”或“=”)。
,则浓硫酸与稀氢氧化钠溶液反应生成1mol水,放出的热量________57.3 kJ(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NO、NO2、碳氢化合物等多种污染物。回答下列问题:
(1)已知:2C8H18(1)+25O2(g)=16CO2(g)+18H2O(g) △H1=-10244kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2
2NO(g)+2CO(g)=N2(g)+2CO2(g) △H3=-746kJ·mol-1
①若H2O(1)=H2O(g) △H=+44kJ·mol-1,则表示辛烷燃烧热的热化学方程式为______________________________________________。
②部分化学键键能数据如下:
化学键 | O=O | C=O | C≡O |
E/(kJ·mol) | 494 | 799 | 1076 |
△H2=__________kJ·mol-1
(2)1573K时,N2+O2![]() 2NO平衡常数为2. 0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0. 2mol、0. 001mol,则生成NO的物质的量为__________mol,N2的转化率为__________。
2NO平衡常数为2. 0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0. 2mol、0. 001mol,则生成NO的物质的量为__________mol,N2的转化率为__________。
(3)反应NO(g)+CO(g)=N2(g)+CO2(g)的平衡常数为1. 68×1060,从热力学角度看,该反应程度应该很大,实际汽车尾气中该反应的程度很小,原因是________________,要增大汽车尾气净化装置中单位时间内该反应的程度,关键是要_____________。
(4)T<500K时,反应NO2(g)+CO(g)=NO(g)+CO2(g)分两步进行:
第一步:NO2(g)+NO2(g)→NO3(g)+NO(g) (慢反应)
第二步:NO3(g)+CO(g)→NO(g)+CO2(g) (快反应)
下列表述正确的是__________(填标号)
A. 反应速率与NO浓度有关 B. 反应速率与NO2浓度有关
C. 反应的中间产物只有NO3 D. 第二步反应活化能较高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com