
【题目】下列生产或实验事实引出的结论不正确的是( )
选项 | 事实 | 结论 |
A | 其他条件相同, | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | 工业制硫酸过程中,在 | 增大气液接触面积,使 |
C | 在2L密闭容器中发生反应:
| 反应速率减慢 |
D | A、B两支试管中分别加入等体积5%的 | 当其他条件不变时,催化剂可以改变化学反应速率 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是(已知质子交换膜的作用是只允许H+通过)( )
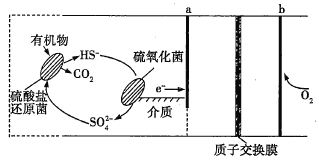
A.该电池在高温下工作的速度更快
B.HS-在硫氧化菌作用下转化为S的电极反应式为HS-+4H2O-8e-=SO42-+9H+
C.b电极是电池的负极
D.该电池工作时,H+向左通过质子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应如下:CO(g)+2H2(g)CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
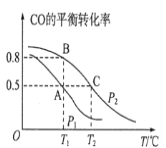
①A、B两点对应的压强大小关系是PA________PB(填“>、<、=”)。
②A、B、C三点的平衡常数KA,KB,KC的大小关系是______。
③下列叙述能说明上述反应能达到化学平衡状态的是__(填代号)。
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变 c.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
(2)在P1压强、T1℃时,该反应的平衡常数K=___,再加入1.0molCO后重新到达平衡,则CO的转化率__(填“增大,不变或减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在指定条件下能实现的是
A.Cu ![]() Cu2(OH)2CO3
Cu2(OH)2CO3 ![]() Cu(OH)2
Cu(OH)2
B.MgO![]() MgCl2(aq)
MgCl2(aq) ![]() MgCl2(s)
MgCl2(s)
![]() C.CaCl2(aq)
C.CaCl2(aq) ![]() CaCO3
CaCO3 ![]() CaSiO3
CaSiO3
D.S![]() SO3
SO3 ![]() H2SO4
H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验设计和操作中必须十分重视安全问题和环境保护问题。下列实验问题处理方法不正确的是( )
①配制稀硫酸时,可先在烧杯中加一定体积的水,再边搅拌边加入浓硫酸
②在气体发生装置上直接点燃一氧化碳气体时,必须先检验一氧化碳气体的纯度。最简单的方法是用排空气的方法收集一试管气体,点燃气体,听爆鸣声
③实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室
④给试管中的液体加热时不时移动试管,以免暴沸伤人
⑤不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛
A.②③B.②⑤C.③④D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】公元八世纪,Jabir ibn Hayyan在干馏硝石的过程中首次发现并制得硝酸(4KNO3![]() 2K2O+4NO↑+3O2↑),同时他也是硫酸和王水的发现者。下列说法正确的是
2K2O+4NO↑+3O2↑),同时他也是硫酸和王水的发现者。下列说法正确的是
A. 干馏产生的混合气体理论上可被水完全吸收
B. 王水是由3体积浓硝酸与1体积浓盐酸配制而成的
C. 王水溶解金时,其中的盐酸作氧化剂(Au+HNO3+4HCl=H[AuCl4]+NO↑+2H2O)
D. 实验室可用NaNO3与浓硫酸反应制备少量的HNO3,利用的是浓硫酸的氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灼热的焦炭与水蒸气反应所得产物为H2、CO和少量CO2,为了检验产物中的H2和CO(设气体均被充分吸收),设计如下实验装置。下列有关说法错误的是
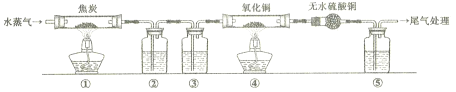
A. 为了实验安全,应先点燃①处酒精灯,后点燃④处酒精灯
B. ②、③、⑤中依次盛装氢氧化钠溶液、浓硫酸和澄清石灰水
C. ④中黑色固体变红色,即可证明产物中一定含有H2和CO中的一种或两种
D. 若用碱石灰替换无水硫酸铜,也可以达到检验H2和CO目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,反应:A(s)+2B(g)![]() C(g) +D(g)。下列不能表明反应
C(g) +D(g)。下列不能表明反应
达到平衡状态的是( )。
A.气体的压强不变B.气体平均相对分子质量不变
C.气体的密度不变D.B物质的量浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2 L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)![]() C(g)+xD(g) ΔH>0,容器中A、B、D的物质的量随时间的变化如图所示。下列说法正确的是( )
C(g)+xD(g) ΔH>0,容器中A、B、D的物质的量随时间的变化如图所示。下列说法正确的是( )

A.反应前10 min内反应的平均速率为v(D)=0.3 mol·L-1·min-1
B.若平衡时保持温度不变,压缩容器体积,平衡逆向移动,平衡常数K值减小
C.反应至15 min时,其他条件不变,改变的条件可能是缩小容器体积
D.反应至15 min时,其他条件不变,改变的条件可能是降低反应体系温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com