
【题目】苯甲酸是一种重要的化工原料。实验室合成苯甲酸的原理、有关数据及装置示意图如下:


名称 | 性状 | 熔点/℃ | 沸点/℃ | 密度(g/mL) | 水溶性 |
甲苯 | 无色易挥发液体 | -95 | 110.6 | 0.8669 | 不溶 |
苯甲酸 | 白色晶体 | 112.4 | 248 | 1.2659 | 微溶 |
苯甲酸在水中的溶解度表:
温度/℃ | 25 | 50 | 95 |
溶解度/g | 0.344 | 0.849 | 6.8 |
某学习小组在实验室制备、分离、提纯苯甲酸,并测定所得样品的纯度,步骤如下:
一、制备苯甲酸
在三颈瓶中加入2.7mL甲苯、100mL水和2~3片碎瓷片,开动电动搅拌器,a中通入流动水,在石棉网上加热至沸腾,然后分批加入8.5g KMnO4(过量),继续搅拌约4~5 h,直至反应完全,停止加热和搅拌,静置。
二、分离提纯
将反应混合液放在冰水浴中冷却,然后用稀硫酸酸化,苯甲酸全部析出后减压过滤,将沉淀物用少量冷水洗涤,干燥,得到粗产品。
三、测定纯度
称取m g产品,配成100mL乙醇溶液,移取25.00mL溶液于锥形瓶,滴加2~3指示剂,然后用标准浓度KOH溶液滴定。
请回答下列问题:
(1)仪器a的名称是____________,其作用为_________________________。
(3)分离提纯阶段产品减压过滤时用冷水洗涤的原因是______________________________。
(4)进一步提纯苯甲酸粗产品的操作是_____________。
(5)测定纯度阶段,所选的指示剂为_________,滴定终点的现象是________________。若m=1.200 g,滴定时用去0.1200 mol/L标准KOH溶液20.00 mL,则所得产品中苯甲酸的纯度(质量分数)为_________。
【答案】 球形冷凝管 冷凝回流甲苯,提高其转化率 反应混合液分层现象消失,不再有油状液体回流 减少苯甲酸的损失 重结晶 酚酞 溶液由无色变为浅红色,且半分钟内不褐色 97.60%
【解析】(1)根据仪器的构造,装置a的名称是球形冷凝管,其作用为冷凝回流,防止甲苯的挥发而降低产品产率。(2)根据题给信息,甲苯被高锰酸钾氧化为苯甲酸钾,高锰酸钾被还原成MnO2,因此制备阶段反应完全的现象是反应混合液分层现象消失,不再有油状液体回流;(3)根据表格所给信息,苯甲酸在冷水中的溶解度较小,用冷水洗涤可以减少产品的损失,所以产品减压过滤时用冷水洗涤;(4)根据题给信息,苯甲酸在水中的溶解性很小,所以将粗产品进一步提纯的最佳操作是重结晶。(5)酚酞作指示剂,在乙醇溶液中无色,用KOH溶液滴定,过量时溶液呈红色,所以滴定终点溶液的颜色变化是溶液由无色变浅红色,且半分钟不退色;设滴定过程中消耗苯甲酸 xg,则
![]()
122 g 1 mol
x 0.12×0.02
解得x=0.2976 g
则所得产品中苯甲酸的质量分数为0.2976×4/1.200×100%= 97.6%。


科目:高中化学 来源: 题型:
【题目】金属铁盐或其氧化物在生产生活和科学实验中应用广泛。
(1)一定条件下Fe2O3与甲烷反应制取纳米级铁,同时生成CO和H2。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-27.6kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.4kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.0kJ/mol
①反应Fe2O3(s)+3 CH4(g)![]() 2Fe(s)+3CO(g) +6H2(g)的△H______0(填“>”、“<”或“=”)
2Fe(s)+3CO(g) +6H2(g)的△H______0(填“>”、“<”或“=”)
②若该反应在5L的密闭容器中进行,1min后达到平衡,测得体系中固体质量减少0.96g。则该段时间内CO的平均反应速率为__________。
③若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是______(选填序号)
a.c(CH4)=c(CO)
b.固体的总质量不变
c.v(CO)与v(H2)的比值不变
d.混合气体的平均相对分子质量不变
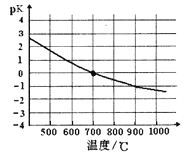
④该反应的化学平衡常数的负对数pK随反应温度T的变化曲线如下图。试用平衡移动原理解释该曲线的变化规律:______________________。若700℃时测得c平衡(H2)=1.0mol·L-1,则CH4的转化率为_________。
(2)菱铁矿的主要成分是:FeCO3,实验室中可以通过FeSO4与NaHCO3溶液混合制得FeCO3,有关反应的离子方程式为:____________________。已知Ksp[FeCO3]=3.2×10-11,H2CO3的Ka1=4.30×10-7,Ka2=5.61×10-11。试通过以上数据简要计算说明该反应能进行的原因_____________________。
(3)Na2FeO4是一种高效净水剂,工业上以Fe为阳极,NaOH为电解质溶液进行电解制备, 写出阳极电极反应式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钡的活动性介于钠和钾之间,下列叙述正确的是( )
A. 钡与水反应不如钠与水反应剧烈
B. 钡可以从KCl溶液中置换出钾
C. 氧化性:K+>Ba2+>Na+
D. 碱性:KOH>Ba(OH)2>NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将不可再生的天然气、石油、煤等化石燃料转化利用、变废为宝已成为当务之急。
(1)根据键能数据估算CH4+4F2=CF4+4HF的反应热ΔH= 。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
(2)甲醇、二甲醚(CH3OCH3)被称为21世纪的新型燃料,均可利用CO和H2反应合成。
①某燃料电池以二甲醚为原料,熔融碳酸盐为电解质,其负极反应如下:
CH3OCH3+6CO![]() -12e-=8CO2+3H2O。写出该燃料电池的正极反应式: 。
-12e-=8CO2+3H2O。写出该燃料电池的正极反应式: 。
②废水中含甲醇对水质会造成污染,Co3+可将甲醇氧化为CO2。某同学以Pt作电极电解酸性含甲醇废水与CoSO4混合液模拟工业除污原理,其阳极反应式为 。
(3)某企业采用如图所示原理处理化石燃料开采、加工过程产生的H2S废气。
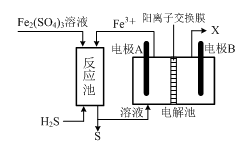
①电解池中电极A、B均为惰性电极,其中A为电解池的 极;电极B所得到的物质X的分子式为 。
②反应池中发生的离子反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某CH4和CO组成的混合气体与氢气的密度比为12.5,现有该混合气体33.6L(标准状况条件下)在氧气中充分燃烧,将所得气体通过装有足量的浓硫酸的试剂瓶,求试剂瓶增重____________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化属于取代反应的是( )
A. 苯与溴水混合,水层褪色 B. 甲苯制三硝基甲苯
C. 乙醇在浓硫酸作用下制取乙烯 D. 苯和氯气在一定条件下生成六氯环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋葛供《肘后备急方》中“青蒿一握,以水升渍,绞取汁,尽服之”。下列操作与“渍”和“绞”原理相近的是( )
A. 浸泡 过滤 B. 煮沸 研碎 C. 萃取 剪断 D. 蒸馏 捣碎
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2014新课标2】37.[化学选修——3:物质结构与性质]
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能最大的是 (填元素符号),e的价层电子轨道示意图为 。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ;分子中既含有极性共价键,又含有非极性共价键的化合物是 (填化学式,写两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是 ;酸根呈三角锥结构的酸是 。(填化学式)
(4)e和c形成的一种离子化合物的晶体结构如图1,则e离子的电荷为 。
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图2所示)。该化合物中阴离子为 ,阳离子中存在的化学键类型有 ;该化合物加热时首先失去的组分是 ,判断理由是 。
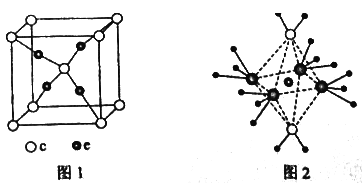
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com