
����Ŀ����ͼΪʵ�������屽��װ��ͼ�����������գ�

��1���÷�Ӧ�Ļ�ѧ����ʽ��___��
��2��˫��U�ι���ʢ��CCl4����;��___��
��3��A����˿�����ã�___��
��4����Һ©����Һ�����A�е�ʵ������___��
��5����A�л��Һ������ˮ�����л�ɫҺ�������ԭ�����屽�л���___ (�ѧʽ)����γ�ȥ�������������Լ���___����Ӧ����Ϊ___��
��6��B�Թ�����������������Һ����ʵ�������ǣ�___��������������Һ��Ŀ����Ϊ�˼���___���ѧʽ�������ɣ��Ӷ�֤���÷�ӦΪ___���Ӧ���ͣ���
���𰸡�![]() ����Br2 ������ �к���ɫ������� Br2 NaOH ��Һ ����dz��ɫ���� HBr ȡ����Ӧ
����Br2 ������ �к���ɫ������� Br2 NaOH ��Һ ����dz��ɫ���� HBr ȡ����Ӧ
��������
��1�����廯�������������£���ͱ�����ȡ����Ӧ�����屽��
��2����ͱ��ӷ����������ɵ�HBr�к�����ͱ������ܺ���������Ӧ���ɵ���ɫ��������HBr������ɸ��ţ����塢�����������Ȼ�̼��
��3�������巴Ӧ�����廯������������ã�
��4����Ӧ���ȣ���ӷ����к���ɫ���������
��5��Br2��NaOH��Ӧ���屽��֮�ֲ㣬�ٷ�Һ��
��6�����廯�������������£���ͱ�����ȡ����Ӧ�����屽���廯�⣬������������Һ���м��顣
��1��ʵ�������屽������Һ���뱽���廯���Ĵ��·�Ӧ�����屽���廯�⣬��Ӧ�Ļ�ѧ����ʽΪ![]() ��
��
��2����ͱ��ӷ����������ɵ�HBr�к�����ͱ������ܺ���������Ӧ���ɵ���ɫ��������HBr������ɸ��ţ����塢�����������Ȼ�̼������˫��U����ʢ�ŵ��Լ���CCl4������������������������ֹ����HBr�ļ��飻
��3��A����˿�����ã������巴Ӧ�����廯������������ã�
��4����Һ©����Һ�����A�У���Ӧ���ȣ���ӷ����к���ɫ���������
��5����A�л��Һ������ˮ�����л�ɫҺ�������ԭ�����屽�л���Br2����γ�ȥ�����ʣ�����ǿ�������䷴Ӧ����ȥ���������Լ���NaOH����Ӧ���屽��֮�ֲ㣬��Ӧ����Ϊ��Һ��
��6��B�Թ�����������������Һ�����е��廯����ˮ��Һ�е���������������������ӷ�Ӧ�����廯����������ʵ�������ǣ�����dz��ɫ������������������Һ��Ŀ����Ϊ�˼���HBr�����ɣ��Ӷ�֤���÷�ӦΪȡ����Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���������(����)
A. ![]() ��������������Ϊ7��1
��������������Ϊ7��1
B. ijԪ����̬��̬ԭ�ӵ�������(kJmol��1)�ֱ�Ϊ738��1451��7733��10540��13630��17995��21703��������������Ӧʱ�������ɵ���������X2+
C. C22����O22+��Ϊ�ȵ����壬1 mol O22+�к��е�������ĿΪ2NA, O22+�ĵ���ʽ�ɱ�ʾΪ ![]()
D. ��֪��ӦN2O4(l)+2N2H4(l)�T3N2(g)+4H2O(l)�����÷�Ӧ����4 mol N��H�����ѣ����γɵ�������ĿΪ3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ���H+��Na+��NH4+��Mg2+��Fe3+��Al3+��SO42����HCO3�������ӣ��������Һ�м���һ�����ʵ���Ũ�ȵ�NaOH��Һʱ���������ɳ��������ʵ�����NaOH��Һ������仯��ͼ����ͼ��ʾ������˵����ȷ���ǣ�������

A.ԭ��Һ�к��е�Fe3+��Al3+�����ʵ���֮��Ϊ1��1
B.ab�η��������ӷ�ӦΪ��Al3++3OH��=Al��OH��3����Mg2++2OH��=Mg��OH��2��
C.ԭ��Һ�к��е������ӱض���H+��NH4+��Al3+�����ܿ϶�Mg2+��Fe3+���е���һ��
D.d����Һ�к��е�����ֻ��Na2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ���⾧ʯ(MgAl2O4)�����ͻ���ϡ��������Ʊ��⾧ʯ�ķ����ǣ���AlCl3��MgCl2�Ļ����Һ(��a��ʾ)������İ�ˮ(��b��ʾ)��Ӧ���ٽ��õ��ij������±��ա����������գ�
��1��ΪʹMg2+��Al3+ͬʱ���ɳ�����Ӧ�ð�_____������a������b����������һ��Һ�С�
��2���������Ʊ���Ӧ�в���Ԫ�صļ����ӣ�Al3+��Cl�C��Mg2+��H+��O2�C���뾶�ɴ�С��˳������
______________________�������ӷ��ű�ʾ����
��3��AlCl3�백ˮ��Ӧ�ķ�Ӧ����������У��������ӻ�����ĵ���ʽ��_________������������ĵ��뷽��ʽ_____________________________��
��4������˵����Ԫ�صķǽ����Աȵ�Ԫ��ǿ����ʵ��_________��
a. H2O��NH3�ȶ� b. ���õ��Ӷ�ƫ��H-O��H-N
c. �е㣺H2O��NH3 d. NO�е���+2�ۣ�����-2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ӱ������еõ�һ����A��C10H16��������������������A�ȹط�Ӧ���£�
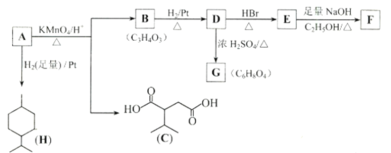
��֪��
���������գ�
��1��H�ķ���ʽΪ____________��B���������ŵ�����Ϊ_________��
��2��B![]() D��D
D��D![]() E�ķ�Ӧ���ͷֱ�Ϊ__________��__________��
E�ķ�Ӧ���ͷֱ�Ϊ__________��__________��
��3��������-COOCH3���ŵ�C��ͬ���칹�干��______�֣������������칹��������ֻ�����ֻ�ѧ������ͬ����ԭ�ӵ��칹��Ľṹ��ʽΪ___________��
��4��GΪ����Ԫ���Ļ����д����ṹ��ʽ�����ʽ_________��
��5��д��E��F�Ļ�ѧ����ʽ________��
��6��A�Ľṹ��ʽ�����ʽΪ________��A������ʵ�����Br2���мӳɷ�Ӧ�IJ��ﹲ��_________�֣������������칹����
��7���Ա�ϩΪԭ�Ϻϳ�B�����Լ���ѡ�������ϳ�·��ͼ________�����ϳ�·�߳��õı�ʾ��ʽΪ��A![]() B
B ![]() ����Ŀ����
����Ŀ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�2NH3(g)+NaClO(aq)��NaCl(aq)+N2H4(aq)+H2O(l)���Է����У�����������N2H4�������й�˵����ȷ����
A.�÷�Ӧ�ġ�H��0����S��0
B.ÿ����1mol N2H4ת��2mol����
C.�����£���0.lmol/L NaClO��Һ�м�ˮ����ҺpH����
D.N2H4��O2��KOH��Һ��ɵ�ȼ�ϵ�أ�������ӦΪ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. NO2��BF3��NCl3������û��һ��������ԭ�ӵ��������Ӷ�������8�����ȶ��ṹ
B. P4��CH4�������������η����Ҽ��Ƕ�Ϊ109��28��
C. NH4+�ĵ���ʽΪ 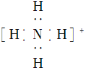 �����ӳ�ƽ�������νṹ
�����ӳ�ƽ�������νṹ
D. NH3��������һ��δ�ɼ��ŵ��Ӷԣ����Գɼ����ӵ��ų����ý�ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڼ��������¿ɻ�ԭ����ͭ����������ˮ�����⣬����̼�������ij��ѧС��������ͼװ��̽���䷴Ӧ���
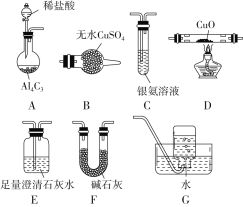
���������ϣ�
��CO����������Һ��Ӧ��CO��2Ag(NH3)2����2OH��=2Ag����2NH4����CO32����2NH3��
��Cu2OΪ��ɫ������Ag����Ӧ��������Ӧ��Cu2O��2H��=Cu2����Cu��H2O��
��1��װ��A�з�Ӧ�Ļ�ѧ����ʽΪ__________________________��
��2�������������װ�ô����ҵ�����˳��ΪA��_____________________��
��3��ʵ���еμ�ϡ����IJ�����_________________________��
��4����֪��������к���CO����װ��C�п��ܹ۲쵽��������___________________________��װ��F������Ϊ____________________��
��5������Ӧ������װ��D���Թ��й���ȫ����Ϊ��ɫ��
�����ʵ��֤����ɫ�����к���Cu2O��______��
����֤����ɫ�������Ƿ���Cu����ͬѧ�������ʵ�飺��������ɫ�����м���������0.1 mol/L AgNO3��Һ��������Һ�������ݴ��жϺ�ɫ�����к���Cu����ͬѧ��Ϊ�÷�������������֤����ͬѧ�Ľ��ۣ�����Ҫ���ӶԱ�ʵ�飬��ɱ������ݡ�
ʵ�鲽��(��Ҫ��д������IJ�������) | Ԥ����������� |
________________________ | ���۲쵽��Һ����������֤����ɫ�����к���Cu |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��������Ϊͬ���칹�壬��ṹʽ�ֱ�����
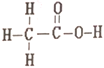 ��
��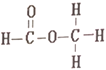
���������ּ��������ʾ�����ź�����ȫ��ͬ��
A. ���ϣԪ�ط����� B. ���������
C. �˴Ź����� D. ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com