
【题目】下列说法中正确的是
A. NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B. P4和CH4都是正四面体形分子且键角都为109°28′
C. NH4+的电子式为 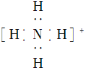 ,离子呈平面正方形结构
,离子呈平面正方形结构
D. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
【答案】D
【解析】
A.在ABn型化合物中,中心元素A的族序数+成键数=8时,满足分子中所有原子都满足最外层8电子结构,含H元素的化合物一定不满足;
B.白磷和甲烷分子都是正四面体结构,但甲烷分子中氢原子位于顶点上,碳原子位于体心上;
C.铵根离子和甲烷分子结构相似,根据甲烷分子结构确定铵根离子结构;
D.分子中,孤电子对对成键电子对的排斥力较大。
A. NCl3分子原子的最外层电子都满足了8电子稳定结构,故A错误;
B. 白磷的键角是60°,故B错误;
C. NH4+呈正四面体型结构,故C错误;
D.分子中,孤电子对对成键电子对的排斥力大于成键电子对对成键电子对的排斥力,所以NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强,故D正确;
答案选D。


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】实验室有一瓶淡黄色粉末,标签已脱落。某学习小组为确定其成分,进行实验探究。
(提出猜想)淡黄色粉末成分可能是
猜想一:硫黄
猜想二:过氧化钠
(实验步骤)
①按下图组装仪器;
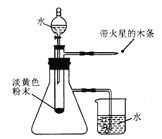
②………
③打开分液漏斗,滴加水;
④用带火星的木条靠近导气管的尖嘴处。
(实验现象)试管中剧烈反应,产生大量气泡;带火星的木条复燃;小烧杯中的导管口有气泡冒出;试管内最终得到无色溶液。
(结论与分析)
(1)实验步骤②迸行的操作是_______;(填字母代号)
A.先加入试剂,后检查装置气密性 B.先检查装置气密性,后加入试剂
(2)根据上述现象分析,猜想________正确;
(3)带火星的木条复燃,说明反应生成的气体是________;
(4)小烧杯中的导管口有气泡冒出,说明淡黄色粉末与水反应是_________(填“放热”或“吸热”)反应;
(5)淡黄色粉末与水反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子的检验方法一定正确的是( )
A.向某溶液中滴加![]() 溶液,有白色沉淀,再滴加足量稀
溶液,有白色沉淀,再滴加足量稀![]() ,若沉淀不溶解,则原溶液中一定含
,若沉淀不溶解,则原溶液中一定含![]()
B.向某溶液中滴加![]() 溶液,若出现红色则原溶液中含
溶液,若出现红色则原溶液中含![]()
C.向某溶液中滴加足量稀盐酸,产生气体使澄清石灰水变浑浊,则原溶液中含![]()
D.用铂丝蘸取某溶液在酒精灯火焰上灼烧,未观察到紫色火焰,则原溶液中不含![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为![]() 的
的![]() 溶液和
溶液和![]() 溶液按体积分别为Va和Vb混合,保持
溶液按体积分别为Va和Vb混合,保持![]() ,且生成的
,且生成的![]() 可溶于水。已知
可溶于水。已知![]() 与混合液pH关系如图。下列说法错误的是( )
与混合液pH关系如图。下列说法错误的是( )
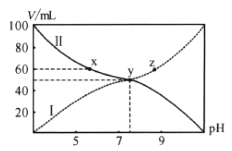
A.曲线Ⅰ表示![]() 溶液体积B.
溶液体积B.![]() 点存在
点存在![]()
C.电离平衡常数![]() D.向
D.向![]() 点溶液加入
点溶液加入![]() ,水的电离程度减小
,水的电离程度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄色超氧化钾(![]() )可作为宇宙飞船舱的氧源。某学习小组设计以下实验探究
)可作为宇宙飞船舱的氧源。某学习小组设计以下实验探究![]() 的性质,请回答相关问题:
的性质,请回答相关问题:
Ⅰ.探究![]() 与水的反应:取少量
与水的反应:取少量![]() 固体于试管中,滴加少量水快速产生气泡,将带火星的木条靠近试管口木条复燃;滴加酚酞试液,溶液先变红后褪色。向褪色后溶液中滴加
固体于试管中,滴加少量水快速产生气泡,将带火星的木条靠近试管口木条复燃;滴加酚酞试液,溶液先变红后褪色。向褪色后溶液中滴加![]() 溶液,产生的现象为____________________________________。
溶液,产生的现象为____________________________________。
Ⅱ.探究![]() 与
与![]() 的反应:
的反应:
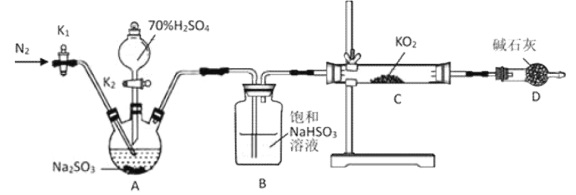
(1)检查上述装置气密性的方法是__________________________________。
(2)正确的操作依次是_________________________。(操作可重复选择)
①打开![]() 通入
通入![]() ,并维持一段时间后关闭 ②实验完成,拆卸装置 ③检查装置气密性,然后装入药品 ④打开分液漏斗活塞
,并维持一段时间后关闭 ②实验完成,拆卸装置 ③检查装置气密性,然后装入药品 ④打开分液漏斗活塞![]()
(3)A装置发生反应的化学方程式为________________________。
(4)用上述装置验证“![]() 与
与![]() 反应生成
反应生成![]() ”还存在不足,你的改进措施是___________________。
”还存在不足,你的改进措施是___________________。
(5)改进后再实验,待![]() 完全反应后,将装置C中固体加水溶解,配成
完全反应后,将装置C中固体加水溶解,配成![]() 溶液,等分为
溶液,等分为![]() 两份。
两份。
①向M溶液中加入足量的盐酸酸化的![]() 溶液,充分反应后,将沉淀过滤、_______、________,称重为4.66g。
溶液,充分反应后,将沉淀过滤、_______、________,称重为4.66g。
②将N溶液移入锥形瓶中,用![]() 酸性
酸性![]() 溶液滴定,当出现_______________现象时,达到滴定终点,此时消耗酸性
溶液滴定,当出现_______________现象时,达到滴定终点,此时消耗酸性![]() 溶液
溶液![]() 。
。
③依据上述现象和数据,请写出装置C中总反应的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HA的酸性弱于HB的酸性。25℃时,用NaOH固体分别改变物质的量浓度均为0.1molL-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的物质的量浓度的负对数与溶液的pH的变化情况如图所示。下列说法正确的是( )
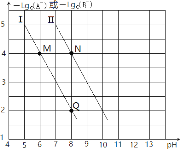
A.曲线Ⅰ表示溶液的pH与-lgc(A-)的变化关系
B.![]() =1000
=1000
C.溶液中水的电离程度:M>N
D.N点对应的溶液中c(Na+)<Q点对应的溶液中c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
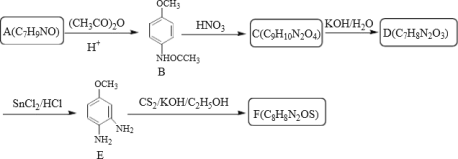
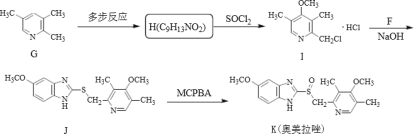
【题目】奥美拉唑主要用于十二指肠溃疡和胃溃的治疗,静脉注射可用于消化性溃疡急性出血的治疗,反应中间体F和奥美拉唑的合成路线如图:
I>中间体F的合成:
II.奧美拉唑的合成:
已知:R-OH![]() R-Cl
R-Cl
R1-SH+R2-X![]() R1-S-R2
R1-S-R2
结合上述合成路线,请回答:
(1)下列说法正确的是_____。
A.奥美拉唑的分子式为C18H19N3O3S
B.J生成K的反应类型为加成反应
C.化合物C可以发生的反应类型有取代、还原、加成
D.设计A转化为B的目的是保护其中的官能团
(2)化合物F的结构简式为_____;
(3)请写出A→B的反应方程式_____;
(4)试写出同时满足下列条件的化合物H的同分异构体:_____。
①分子中含苯环,遇FeC13显紫色
②分子中含有4种不同化学环境的氢原子。
(5)利用已有知识和题中涉及的反应,设计从乙烯合成![]() 的路线_____。(用流程图表示,无机试剂任选)
的路线_____。(用流程图表示,无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值,下列有关叙述正确的是()
A.将78gNa2O2与过量CO2反应转移的电子数为2NA
B.1molN2与4molH2反应生成的NH3分子数为2NA
C.标准状况下,2.24LSO3中所含原子数为0.4NA
D.标准状况下,18gD2O中所含电子数为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。Fe在元素周期表中的位置为__________。科学家在研究金属矿物质组分的过程中。发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体的方法是_____________。
②已知:r(Fe2+)为61 pm,r(Co2+)为65 pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是_______。
③下表是Fe和Cu的部分电离能数据,请解释I2(Cu)大于I2(Fe)的主要原因是__。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第一电离能I2/kJ·mol-1 | 1561 | 1958 |
(2)原子序数依次增大的五种元素A、B、C、D、E分别处于第一至第四周期,A是前四周期中原子半径最小的元素,B原子核外电子有6种不同的运动状态,常温下C的单质是空气中含量最多的成份,D最高价氧化物对应水化物的酸性最强,E的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
①B2A2的电子式是___,D所在主族的前四种元素分别与A形成的化合物,其共价键的极性由强到弱的顺序是___(填化学式)。
②A和C形成的简单化合物遇到D单质出现白烟现象,写出有关反应的化学方程式为____。
③向E的硫酸盐溶液中滴加过量氨水,观察到的现象是首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,请写出最后-步得到深蓝色透明溶液对应的离子方程式____。
(3)金属镓有“电子工业脊梁“的美誉,镓及其化合物应用广泛。砷化镓是半导体材料属立方晶系,其晶胞结构如图所示。
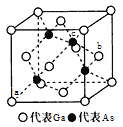
①晶胞中,与Ga原子等距离且最近的As原子形成的空间构型为____。
②原子坐标参数是晶胞的基本要素之-,表示晶胞内部各原子的相对位置,图中a(0,0,0)、b(1,![]() ,
,![]() ),则c原子的坐标参数为_____。
),则c原子的坐标参数为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com