
【题目】(1)①为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。Fe在元素周期表中的位置为__________。科学家在研究金属矿物质组分的过程中。发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体的方法是_____________。
②已知:r(Fe2+)为61 pm,r(Co2+)为65 pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是_______。
③下表是Fe和Cu的部分电离能数据,请解释I2(Cu)大于I2(Fe)的主要原因是__。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第一电离能I2/kJ·mol-1 | 1561 | 1958 |
(2)原子序数依次增大的五种元素A、B、C、D、E分别处于第一至第四周期,A是前四周期中原子半径最小的元素,B原子核外电子有6种不同的运动状态,常温下C的单质是空气中含量最多的成份,D最高价氧化物对应水化物的酸性最强,E的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
①B2A2的电子式是___,D所在主族的前四种元素分别与A形成的化合物,其共价键的极性由强到弱的顺序是___(填化学式)。
②A和C形成的简单化合物遇到D单质出现白烟现象,写出有关反应的化学方程式为____。
③向E的硫酸盐溶液中滴加过量氨水,观察到的现象是首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,请写出最后-步得到深蓝色透明溶液对应的离子方程式____。
(3)金属镓有“电子工业脊梁“的美誉,镓及其化合物应用广泛。砷化镓是半导体材料属立方晶系,其晶胞结构如图所示。
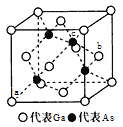
①晶胞中,与Ga原子等距离且最近的As原子形成的空间构型为____。
②原子坐标参数是晶胞的基本要素之-,表示晶胞内部各原子的相对位置,图中a(0,0,0)、b(1,![]() ,
,![]() ),则c原子的坐标参数为_____。
),则c原子的坐标参数为_____。
【答案】第四周期Ⅷ族 X射线衍射 Fe2+的半径小于Co2+,FeO的晶格能大于CoO,FeCO3比CoCO3易分解 失去第二个电子时,Cu失去的是全充满3d10电子,Fe失去的是4s1电子 ![]() HF >HCI> HBr >HI 8NH3+3Cl2===N2+6NH4Cl Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2+4H2O+2OH- 正四面体结构 (
HF >HCI> HBr >HI 8NH3+3Cl2===N2+6NH4Cl Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2+4H2O+2OH- 正四面体结构 (![]() ,
,![]() ,
,![]() )
)
【解析】
原子序数依次增大的五种元素A、B、C、D、E分别处于第一至第四周期,A是前四周期中原子半径最小的元素,A是H,B原子核外电子有6种不同的运动状态,B是C。常温下C的单质是空气中含量最多的成份,C是O。D最高价氧化物对应水化物的酸性最强,D是Cl。E的基态原子的最外能层只有一个电子,其他能层均已充满电子,E是Cu。
(1)①Fe在元素周期表中第四周期Ⅷ族,区分晶体和非晶体方法是X射线衍射;
②FeCO3的分解温度低于CoCO3原因是:Fe2+的半径小于Co2+,FeO的晶格能大于CoO,FeCO3比CoCO3易分解;
③结合表中数据I2(Cu)大于I2(Fe)分析,失去第二个电子时,Cu失去的是全充满3d10电子,Fe失去的是4s1电子。所以I2(Cu)大于I2(Fe);
(2)①![]() Cl所在主族的前四种元素分别与H形成的化合物,其共价键的极性由强到弱的顺序是HF >HCI> HBr >HI;
Cl所在主族的前四种元素分别与H形成的化合物,其共价键的极性由强到弱的顺序是HF >HCI> HBr >HI;
②8NH3+3Cl2===N2+6NH4Cl;
③Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2+ 4H2O+2OH-;
(3)①晶胞中,与Ga原子等距离且最近的As原子形成的空间构型为正四面体结构;
②图中a(0,0,0)、b(1,![]() ,
,![]() ),则c原子的坐标参数为(
),则c原子的坐标参数为(![]() ,
,![]() ,
,![]() )。
)。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B. P4和CH4都是正四面体形分子且键角都为109°28′
C. NH4+的电子式为 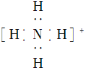 ,离子呈平面正方形结构
,离子呈平面正方形结构
D. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂被誉为“高能金属”,是锂离子电池的电极材料。工业上常用β锂辉矿(主要成分为Li2O·Al2O3·4SiO2以及少量钙、镁杂质)和氟磷灰石(Ca5P3FO12)为原料制取锂离子电池正极材料LiFePO4,工艺流程如图:
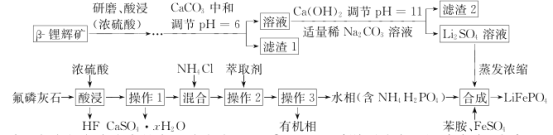
已知:①残留在溶液中的离子浓度小于10-5 mol·L-1 说明该离子沉淀完全;
②常温下,Ksp[Al(OH)3]=2.7×10-34、Ksp[Mg(OH)2]= 1.2×10-1 ;
③LiFePO4难溶于水。
回答下列问题:
(1)氟磷灰石(Ca5P3FO12 )中磷元素的化合价为______ , 滤渣2的主要成分是______(写化学式)。
(2)操作I所需的玻璃仪器名称有烧杯____________,操作 3的名称是_____________。
(3)蒸发浓缩Li2SO4溶液的目的是_____________________。
(4)写出合成反应的离子方程式:____________________________________。
(5)一种锂离子电池的反应原理为LiFePO4![]() Li+FePO4。写出放电时正极电极反应式:_____________________________。
Li+FePO4。写出放电时正极电极反应式:_____________________________。
(6)若某企业制备110.6 t纯净的LiFePO4,需要300t含氧化锂5%的β锂辉矿石,则锂元素的利用率为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z是位于不同周期的主族元素、原子序数依次增大且均小于18,Z为金属元素,X、Y、Z的最外层电子数之和为8,X、Y、Z组成的物质可发生反应:ZX2+2YX3![]() Z(YX2)2+2X2。下列有关说法正确的是
Z(YX2)2+2X2。下列有关说法正确的是
A.1 mol ZX2发生上述反应转移电子的物质的量为4 mol
B.YX3与Y2X4中Y元素的化合价相同
C.上述反应中的离子化合物的所有元素原子的最外层都满足8电子稳定结构
D.Y元素在同周期和同主族元素的最高价含氧酸中酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是
A.18 g 18O含有的中子数为8NA
B.0.1 mol H2C2O4被氧化为CO2转移的电子数为0.1NA
C.标准状况下,a L氧气和氮气的脱合物中含有的原子总数约为![]() NA
NA
D.常温下、含1 mol H2SO4的浓硫酸与足量铜反应,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铜氨废液含[Cu(NH3)3·CO]+、[Cu(NH3)2]2+、[Cu(NH3)4]2+、NH3、CH3COO-、CO32-等中回收铜的工艺流程如图:

(1)步骤(Ⅰ)“吹脱”的目的是___(写一条即可);由步骤(Ⅱ)可确定NH3与H+的结合能力比与Cu2+的___(填“强”或“弱”)。
(2)步骤(Ⅲ)“沉铜”时,Na2S的用量比理论用量多,目的是___。
(3)步骤(Ⅳ)反应中,氧化产物与还原产物的物质的量之比为___。
(4)步骤(Ⅵ)发生反应生成难溶Cu2(OH)3Cl的离子方程式为___,pH与铜的回收率关系如图(a)所示,为尽可能提高铜的回收率,需控制的pH约为___。
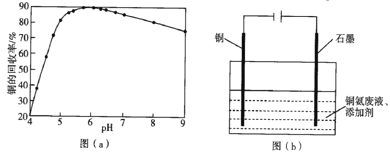
(5)“吹脱”后的铜氨溶液中加入适量的添加剂可直接电解回收金属铜,装置如图(b)所示,阴极主要发生的电极方程式为___;添加NaCl和H2SO4均可提高电导率和电流效率,从而提高铜的回收率,从环境角度考虑,较好的是___(填“NaCl”或“H2SO4”)。
(6)已知上述流程中只有步骤(Ⅲ)“沉铜”和步骤Ⅴ“制硫酸铜”中铜元素有损耗。步骤(Ⅲ)“沉铜”时铜元素的损耗率为4%;步骤Ⅴ“制硫酸铜”时铜元素损耗率为2%。若1L废液最终制得CuSO45H2O375g,则1L废液中含有铜元素的质量为___g。(保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:
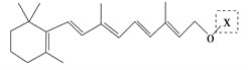
为了研究X的结构,将化合物A在一定条件下水解只得到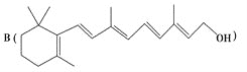 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雌黄(As2S3)在我国古代常用作书写涂改修正液。浓硝酸氧化雌黄可制得硫磺,并生成砷酸和一种红棕色气体,利用此反应原理设计为原电池。下列叙述正确的是( )
A.砷酸的分子式为H2AsO4
B.红棕色气体在该原电池的负极区生成并逸出
C.该反应的氧化剂和还原剂物质的量之比为10:1
D.该反应中每析出4.8g硫磺转移1mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:
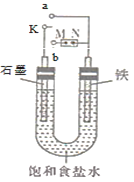
(1)若开始时开关K与a连接,则铁发生电化学腐蚀中的________腐蚀(填“吸氧”或“析氢”),正极发生的电极反应式为_______________。
(2)若开始时开关K与b连接,两极均有气体产生,则N端是电源的________极(填“正”或“负”),电解池总反应的离子方程式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com