
【题目】雌黄(As2S3)在我国古代常用作书写涂改修正液。浓硝酸氧化雌黄可制得硫磺,并生成砷酸和一种红棕色气体,利用此反应原理设计为原电池。下列叙述正确的是( )
A.砷酸的分子式为H2AsO4
B.红棕色气体在该原电池的负极区生成并逸出
C.该反应的氧化剂和还原剂物质的量之比为10:1
D.该反应中每析出4.8g硫磺转移1mol电子
【答案】C
【解析】
A. As位于第四周期VA族,因此砷酸的分子式为H3AsO4,故A错误;
B. 红棕色气体为NO2,N的化合价由+5价→+4价,根据原电池工作原理,负极上发生氧化反应,化合价升高,正极上发生还原反应,化合价降低,即NO2应在正极区生成并逸出,故B错误;
C. 根据题中信息,As的化合价由+3价→+5价,S的化合价由-2价→0价,化合价都升高,即As2S3为还原剂,HNO3为氧化剂,根据得失电子数目守恒,因此有n(As2S3)×[2×(5-3)+3×2]=n(HNO3)×(5-4),因此n(HNO3):n(As2S3)=10:1,故C正确;
D. 4.8g硫磺的物质的量为:![]() =0.15mol,根据硫原子守恒n(As2S3)=0.05mol,根据C 选项分析,1molAs2S3参与反应,转移10mole-,则0.05molAs2S3作还原剂,转移电子物质的量为0.05mol×10=0.5mol,故D错误;
=0.15mol,根据硫原子守恒n(As2S3)=0.05mol,根据C 选项分析,1molAs2S3参与反应,转移10mole-,则0.05molAs2S3作还原剂,转移电子物质的量为0.05mol×10=0.5mol,故D错误;
答案:C。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值,下列有关叙述正确的是()
A.将78gNa2O2与过量CO2反应转移的电子数为2NA
B.1molN2与4molH2反应生成的NH3分子数为2NA
C.标准状况下,2.24LSO3中所含原子数为0.4NA
D.标准状况下,18gD2O中所含电子数为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。Fe在元素周期表中的位置为__________。科学家在研究金属矿物质组分的过程中。发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体的方法是_____________。
②已知:r(Fe2+)为61 pm,r(Co2+)为65 pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是_______。
③下表是Fe和Cu的部分电离能数据,请解释I2(Cu)大于I2(Fe)的主要原因是__。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第一电离能I2/kJ·mol-1 | 1561 | 1958 |
(2)原子序数依次增大的五种元素A、B、C、D、E分别处于第一至第四周期,A是前四周期中原子半径最小的元素,B原子核外电子有6种不同的运动状态,常温下C的单质是空气中含量最多的成份,D最高价氧化物对应水化物的酸性最强,E的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
①B2A2的电子式是___,D所在主族的前四种元素分别与A形成的化合物,其共价键的极性由强到弱的顺序是___(填化学式)。
②A和C形成的简单化合物遇到D单质出现白烟现象,写出有关反应的化学方程式为____。
③向E的硫酸盐溶液中滴加过量氨水,观察到的现象是首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,请写出最后-步得到深蓝色透明溶液对应的离子方程式____。
(3)金属镓有“电子工业脊梁“的美誉,镓及其化合物应用广泛。砷化镓是半导体材料属立方晶系,其晶胞结构如图所示。
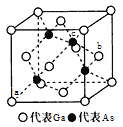
①晶胞中,与Ga原子等距离且最近的As原子形成的空间构型为____。
②原子坐标参数是晶胞的基本要素之-,表示晶胞内部各原子的相对位置,图中a(0,0,0)、b(1,![]() ,
,![]() ),则c原子的坐标参数为_____。
),则c原子的坐标参数为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的化工原料,可由乙烷为原料制取,回答下列问题。
(1)传统的热裂解法和现代的氧化裂解法的热化学方程式如下:
①C2H6(g)=C2H4(g)+H2(g) ΔH1=+136kJ·mol-1
②C2H6(g)+![]() O2(g)=C2H4(g)+H2O(g) ΔH2=-110kJ·mol-1
O2(g)=C2H4(g)+H2O(g) ΔH2=-110kJ·mol-1
已知反应相关的部分化学键键能数据如下:
化学键 | H-H(g) | H-O(g) | O=O |
键能(kJ·mol-1) | 436 | x | 496 |
由此计算x=___,通过比较ΔH1和ΔH2,说明和热裂解法相比,氧化裂解法的优点是___(任写一点)。
(2)乙烷的氧化裂解反应产物中除了C2H4外,还存在CH4、CO、CO2等副产物(副反应均为放热反应),图甲为温度对乙烷氧化裂解反应性能的影响。乙烷的转化率随温度的升高而升高的原因是___,反应的最佳温度为___(填序号)。
A.700℃ B.750℃ C.850℃ D.900℃

[乙烯选择性=![]() ;乙烯收率=乙烷转化率×乙烯选择性]
;乙烯收率=乙烷转化率×乙烯选择性]
(3)烃类氧化反应中,氧气含量低会导致反应产生积炭堵塞反应管。图乙为![]() 的值对乙烷氧化裂解反应性能的影响。判断乙烷氧化裂解过程中
的值对乙烷氧化裂解反应性能的影响。判断乙烷氧化裂解过程中![]() 的最佳值是___,判断的理由是___。
的最佳值是___,判断的理由是___。
(4)工业上,保持体系总压恒定为100kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是___。反应达平衡时,各组分的体积分数如下表:
组分 | C2H6 | O2 | C2H4 | H2O | 其他物质 |
体积分数/% | 2.4 | 1.0 | 12 | 15 | 69.6 |
计算该温度下的平衡常数:Kp=___(用平衡分压代替平衡浓度,平衡分压=总压×体积分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(H2NCOONH4)是一种易分解、易水解的白色固体,易溶于水,难溶于CCl4,某研究小组用如图1所示的实验装置制备氨基甲酸铵。
反应原理:2NH3(g)+CO2(g)![]() NH2COONH4(s) △H<0。
NH2COONH4(s) △H<0。

(1)仪器2的名称是__。仪器3中NaOH固体的作用是__。
(2)①打开阀门K,仪器4中由固体药品所产生的气体就立即进入仪器5,则该固体药品的名称为__。
②仪器6的一个作用是控制原料气按反应计量系数充分反应,若反应初期观察到装置内稀硫酸溶液中产生气泡,应该__(填“加快”、“减慢”或“不改变”)产生氨气的流速。
(3)另有一种制备氨基甲酸铵的反应器(CCl4充当惰性介质)如图2:

①图2装置采用冰水浴的原因为__。
②当CCl4液体中产生较多晶体悬浮物时,即停止反应,__(填操作名称)得到粗产品。
为了将所得粗产品干燥可采取的方法是__。
A.蒸馏 B.高压加热烘干 C.真空微热烘干
(4)①已知氨基甲酸铵可完全水解为碳酸氢铵,则该反应的化学方程式为__。
②为测定某样品中氨基甲酸铵的质量分数,某研究小组用该样品进行实验。已知杂质不参与反应,请补充完整测定某样品中氨基甲酸铵质量分数的实验方案:用天平称取一定质量的样品,加水溶解,__,测量的数据取平均值进行计算(限选试剂:蒸馏水、澄清石灰水、Ba(OH)2溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃是由C、H元素组成的有机物、不同有机物的结构不同。试回答下列问题:
(1)分子式为C6H12的某烯烃的所有的碳原子都在同一个平面上,则该烯烃的结构式___,系统命名为___。
(2)组成符合CnH2n-2的某种烃,分子结构中没有支链或侧链,它完全燃烧时所消耗的氧气的体积是相同状态下该烃蒸气体积的8.5倍。
(a)若该烃为链状烯烃,并且与等物质的量的Br2加成只能得到某单一产物,则该烃的结构简式为___。
(b)若该烃只能与含等物质的量的Br2四氯化碳溶液发生反应,则其结构简式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将亚磷酸氢二钠(Na2HPO3)溶液通过电渗析法来制备亚磷酸(H3PO3)的原理如图所示,下列有关说法错误的是

A.阳极的电极反应式为2H2O-4e-=4H++O2↑
B.在原料室与产品室间设计缓冲室的主要目的是提高产品的纯度
C.阴极的电极反应式为2H2O+2e-=2OH-+H2↑
D.膜①、③、④均为阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将体积均为V0的三种溶液分别加水稀释至体积为V时,pH与V0/V的关系如下图所示:

下列说法正确的是
A. 酸性:HX>HY
B. HX溶液滴定NaOH溶液时指示剂用甲基橙比用酚酞误差小
C. “HX+NaX-混合溶液中,V0/V=10-1时,c(HX)<c(X-)
D. V0/V在10-1~10-3,“HX+NaX”混合溶液随V0/V的减小,X-的水解与HX的电离程度始终保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中各组离子一定能大量共存的是
A.使石蕊试液呈红色的溶液中:Na+、Al3+、NO3-、![]()
B.![]() =0.1 mol·L-1的溶液:Na+、K+、CO32-、NO3-
=0.1 mol·L-1的溶液:Na+、K+、CO32-、NO3-
C.含有0.1 mol·L-1 HCO3-的溶液:Na+、Fe3+、NO3-、SCN-
D.由水电离产生的c(H+)=10-12 mol·L-1的溶液:NH4+,SO42-、HCO3-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com