
【题目】将亚磷酸氢二钠(Na2HPO3)溶液通过电渗析法来制备亚磷酸(H3PO3)的原理如图所示,下列有关说法错误的是

A.阳极的电极反应式为2H2O-4e-=4H++O2↑
B.在原料室与产品室间设计缓冲室的主要目的是提高产品的纯度
C.阴极的电极反应式为2H2O+2e-=2OH-+H2↑
D.膜①、③、④均为阳离子交换膜
【答案】D
【解析】
在阳极室,H2O中的O元素失电子生成O2和H+,H+向产品室移动,膜①为阳膜;则原料室中的HPO32-向缓冲室移动,再向产品室移动,从而得出膜②、AM都为阴膜;在阴极,H2O电离出的H+得电子生成H2和OH-,OH-向产品室移动,则膜④为阴膜;原料室中的Na+向缓冲室再向产品室移动,则膜③、CM膜都为阳膜。
A.在阳极,H2O中的O元素失电子生成O2和H+,电极反应式为2H2O-4e-=4H++O2↑,A正确;
B.为了避免电流效率的损失和提高产品的纯度,在原料室与产品室间设计缓冲室,B正确;
C.阴极为H2O电离出的H+得电子生成H2和OH-,电极反应式为2H2O+2e-=2OH-+H2↑,C正确;
D.膜①、③均为阳离子交换膜,④为阴离子交换膜,D错误;
故选D。


科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂被誉为“高能金属”,是锂离子电池的电极材料。工业上常用β锂辉矿(主要成分为Li2O·Al2O3·4SiO2以及少量钙、镁杂质)和氟磷灰石(Ca5P3FO12)为原料制取锂离子电池正极材料LiFePO4,工艺流程如图:
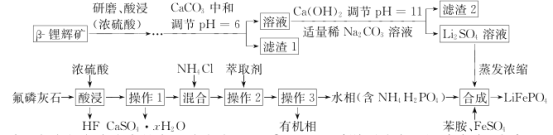
已知:①残留在溶液中的离子浓度小于10-5 mol·L-1 说明该离子沉淀完全;
②常温下,Ksp[Al(OH)3]=2.7×10-34、Ksp[Mg(OH)2]= 1.2×10-1 ;
③LiFePO4难溶于水。
回答下列问题:
(1)氟磷灰石(Ca5P3FO12 )中磷元素的化合价为______ , 滤渣2的主要成分是______(写化学式)。
(2)操作I所需的玻璃仪器名称有烧杯____________,操作 3的名称是_____________。
(3)蒸发浓缩Li2SO4溶液的目的是_____________________。
(4)写出合成反应的离子方程式:____________________________________。
(5)一种锂离子电池的反应原理为LiFePO4![]() Li+FePO4。写出放电时正极电极反应式:_____________________________。
Li+FePO4。写出放电时正极电极反应式:_____________________________。
(6)若某企业制备110.6 t纯净的LiFePO4,需要300t含氧化锂5%的β锂辉矿石,则锂元素的利用率为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:

为了研究X的结构,将化合物A在一定条件下水解只得到 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雌黄(As2S3)在我国古代常用作书写涂改修正液。浓硝酸氧化雌黄可制得硫磺,并生成砷酸和一种红棕色气体,利用此反应原理设计为原电池。下列叙述正确的是( )
A.砷酸的分子式为H2AsO4
B.红棕色气体在该原电池的负极区生成并逸出
C.该反应的氧化剂和还原剂物质的量之比为10:1
D.该反应中每析出4.8g硫磺转移1mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮族元素在化学领域具有重要的地位。请回答下列问题:
(1)基态氮原子的价电子轨道表示式为__;第二周期的元素中,第一电离能介于B和N之间的元素有__种。
(2)雌黃的分子式为As2S3,其分子结构为![]() ,As原子的杂化类型为__。
,As原子的杂化类型为__。
(3)1mol 中所含σ键的物质的量为____mol。已知NF3与NH3分子的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,原因是__。
中所含σ键的物质的量为____mol。已知NF3与NH3分子的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,原因是__。
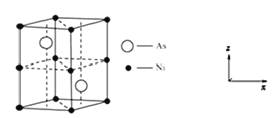
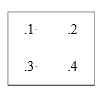
(4)红镍矿是一种重要的含镍矿物,其主要成分的晶胞如图所示,则每个Ni原子周围与之紧邻的As原子数为_____。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。磷化硼(BP)是一种超硬耐磨涂层材料,晶胞为正方体形,晶胞参数为apm。如图为沿y轴投影的晶胞中所有硼原子的分布图和原子分数坐标。设NA为阿伏伽德罗常数的值,1,2,3,4四点原子分数坐标分别为(0.25,0.25,0.75),(0.75,0.25,0.25),(0.25,0.75,0.25),(0.75,0.75,0.75)。据此推断BP晶体的密度为__gcm-3。(用代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将盐酸滴加到Na2X溶液中,混合溶液的pOH[pOH=—lgc(OH-)]与离子浓度变化的关系如图所示。

下列叙述正确的是
A. 曲线N表示pOH与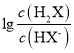 两者的变化关系
两者的变化关系
B. NaHX溶液中c(X2-)>c(H2X)
C. 当混合溶液呈中性时,c(Na+)=c(HX-)+2c(X2-)
D. 常温下,Na2X的第一步水解常数Kh1=1.0×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:
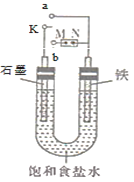
(1)若开始时开关K与a连接,则铁发生电化学腐蚀中的________腐蚀(填“吸氧”或“析氢”),正极发生的电极反应式为_______________。
(2)若开始时开关K与b连接,两极均有气体产生,则N端是电源的________极(填“正”或“负”),电解池总反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解 NaHSO4 溶液制备 Na2S2O8(其中阴离子结构为![]() )。其中阴极材料为 Pb;阳极材料为铂。下列说法不正确的是
)。其中阴极材料为 Pb;阳极材料为铂。下列说法不正确的是
A.SO42-向阳极迁移
B.阳极可换为铜电极
C.阳极反应中 S 的化合价不变
D.阴极电极反应式:2H++2e-=H2↑。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com