
【题目】如图所示:
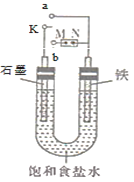
(1)若开始时开关K与a连接,则铁发生电化学腐蚀中的________腐蚀(填“吸氧”或“析氢”),正极发生的电极反应式为_______________。
(2)若开始时开关K与b连接,两极均有气体产生,则N端是电源的________极(填“正”或“负”),电解池总反应的离子方程式为_________。
【答案】吸氧 O2+4e-+2H2O==4OH- 负 2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
【解析】
从图中可以看出,当K与a相连时,形成原电池,Fe作负极,石墨作正极,发生吸氧腐蚀;当K与b相连时,形成电解池,若Fe电极作阳极,则发生Fe-2e-==Fe2+的反应,没有气体产生,不合题意,故Fe电极应作阴极。
(1)若开始时开关K与a连接,则形成原电池,铁发生电化学腐蚀中的吸氧腐蚀,铁作负极,则石墨作正极,发生的电极反应式为O2+4e-+2H2O==4OH-。答案为:吸氧;O2+4e-+2H2O==4OH-;
(2)若开始时开关K与b连接,两极均有气体产生,由以上分析知,Fe作阴极,与电源的负极相连,则N端是电源的负极,发生H2O得电子生成H2和OH-的电极反应,阳极Cl-失电子生成Cl2,则电解池总反应的离子方程式为2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑。答案为:负;2Cl-+2H2O
2OH-+Cl2↑+H2↑。答案为:负;2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑。
2OH-+Cl2↑+H2↑。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】(1)①为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。Fe在元素周期表中的位置为__________。科学家在研究金属矿物质组分的过程中。发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体的方法是_____________。
②已知:r(Fe2+)为61 pm,r(Co2+)为65 pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是_______。
③下表是Fe和Cu的部分电离能数据,请解释I2(Cu)大于I2(Fe)的主要原因是__。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第一电离能I2/kJ·mol-1 | 1561 | 1958 |
(2)原子序数依次增大的五种元素A、B、C、D、E分别处于第一至第四周期,A是前四周期中原子半径最小的元素,B原子核外电子有6种不同的运动状态,常温下C的单质是空气中含量最多的成份,D最高价氧化物对应水化物的酸性最强,E的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
①B2A2的电子式是___,D所在主族的前四种元素分别与A形成的化合物,其共价键的极性由强到弱的顺序是___(填化学式)。
②A和C形成的简单化合物遇到D单质出现白烟现象,写出有关反应的化学方程式为____。
③向E的硫酸盐溶液中滴加过量氨水,观察到的现象是首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,请写出最后-步得到深蓝色透明溶液对应的离子方程式____。
(3)金属镓有“电子工业脊梁“的美誉,镓及其化合物应用广泛。砷化镓是半导体材料属立方晶系,其晶胞结构如图所示。
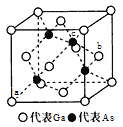
①晶胞中,与Ga原子等距离且最近的As原子形成的空间构型为____。
②原子坐标参数是晶胞的基本要素之-,表示晶胞内部各原子的相对位置,图中a(0,0,0)、b(1,![]() ,
,![]() ),则c原子的坐标参数为_____。
),则c原子的坐标参数为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将亚磷酸氢二钠(Na2HPO3)溶液通过电渗析法来制备亚磷酸(H3PO3)的原理如图所示,下列有关说法错误的是

A.阳极的电极反应式为2H2O-4e-=4H++O2↑
B.在原料室与产品室间设计缓冲室的主要目的是提高产品的纯度
C.阴极的电极反应式为2H2O+2e-=2OH-+H2↑
D.膜①、③、④均为阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将体积均为V0的三种溶液分别加水稀释至体积为V时,pH与V0/V的关系如下图所示:

下列说法正确的是
A. 酸性:HX>HY
B. HX溶液滴定NaOH溶液时指示剂用甲基橙比用酚酞误差小
C. “HX+NaX-混合溶液中,V0/V=10-1时,c(HX)<c(X-)
D. V0/V在10-1~10-3,“HX+NaX”混合溶液随V0/V的减小,X-的水解与HX的电离程度始终保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,工业上可用NO和Cl2合成。回答下列问题:
(1)已知:①2NO2(g)+NaCl(s)NaNO3(s)+NOCl(g) △H1
②4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g) △H2
③2NO(g)+Cl2(g) 2NOCl(g) △H3
则△H3=_____________(用含△H1、△H2的代数式表示)。
(2)一定温度下,向2L密闭容器中充入amol NOCl(g),发生反应2NOCl(g)2NO(g)+Cl2(g)。
①已知上述反应中正反应速率的表达式为v正=k·cn(NOCl)。300℃时,测得正反应速率与NOCl的浓度的关系如表所示:
c(NOCl)/(mol/L) | v正/(molL-1s-1) |
0.20 | 1.6×10-9 |
0.40 | 6.4×10-9 |
0.60 | 1.44×10-8 |
n=______;k=_____L·mol-1·s-1;当c(NOCl)=0.50 mol·L-1时,v正=_____mol·L-1·s-1。
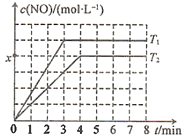
②测得NO的物质的量浓度与温度的关系如图所示(x<0.5a),T1________T2(填“>”“<”或“=”);T2温度下,该反应的平衡常数K=________mol·L-1(用含a、x的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰是重要的合金材料和催化剂,在工农业生产和科技领域有广泛的用途。将废旧锌锰电池回收处理后,将含MnO2、MnOOH、Zn(OH)2及少量Fe的废料进行回收处理,能实现资源的再生利用。用该废料制备Zn和MnO2的一种工艺流程如图:

已知:Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
回答下列问题:
(1)还原焙烧过程中,MnOOH与炭黑反应,锰元素被还原为MnO,该反应的化学方程式为_____。
(2)滤渣1主要成分的化学式是________。
(3)净化阶段
①为了除掉滤渣2中的元素,选择最佳的加入试剂为______(填序号)。
A.氯水 B.O2 C.氨水 D.MnCO3
②已知:室温下,Ksp[Mn(OH)2]=10-13,Ksp[Fe(OH)3]=1×10-38,Ksp[Zn(OH)2]=10-17。净化时溶液中Mn2+、Zn2+的浓度约为0. 1mol·L-1,调节pH的合理范围是______。
(4)将MnO2和Li2CO3按4:1的物质的量比配料,混合搅拌,然后升温至600C~750°C, 制取产品LiMn2O4。写出该反应的化学方程式:________。
(5)LiMn2O4材料常制作成可充电电池(如图),该电池的总反应为![]()
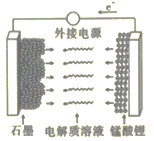
①充电时,锰酸锂为电池的_______(填“正极”“负极”“阴极”或“阳极”);该电极上发生的电极反应式为______________。
②该电池作为电源放电时,若电路中转移0.2mol e-,则石墨电极将减重____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】玻璃钢可由酚醛树脂和玻璃纤维制成。
(1)酚醛树脂有苯酚和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向已有苯酚的反应釜中__加入甲醛,且反应釜应装有__装置;
(2)玻璃纤维由玻璃拉丝得到.普通玻璃是由石英砂、__和石灰石(或长石)高温熔融而成,主要反应的化学方程式为__;
(3)玻璃钢中玻璃纤维的作用是__;玻璃钢具有__等优异性能(写出亮点即可);
(4)下列处理废旧热固性酚醛塑料的做法合理的是__;
a.深埋 b.粉碎后用作树脂填料
c.用作燃料 d.用有机溶剂将其溶解,回收树脂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中各组离子一定能大量共存的是
A.使石蕊试液呈红色的溶液中:Na+、Al3+、NO3-、![]()
B.![]() =0.1 mol·L-1的溶液:Na+、K+、CO32-、NO3-
=0.1 mol·L-1的溶液:Na+、K+、CO32-、NO3-
C.含有0.1 mol·L-1 HCO3-的溶液:Na+、Fe3+、NO3-、SCN-
D.由水电离产生的c(H+)=10-12 mol·L-1的溶液:NH4+,SO42-、HCO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】没食子酸丙酯简称PG,是一种白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。其结构简式如图所示。
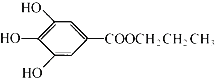
已知:PG经水解可转化为没食子酸,没食子酸能与NaHCO3溶液反应生成CO2
回答下列问题:
(1)从分子结构或性质上看,PG具有抗氧化作用的主要原因是:______(文字简述)
(2)1mol没食子酸最多可以与含________mol碳酸钠的溶液发生反应。
(3)写出PG在NaOH溶液中水解的化学方程式:_______________________。
(4)没食子酸有多种同分异构体,写出其中符合下列要求的同分异构体的结构简式:____。
a.含有苯环,且苯环上的一溴代物只有一种;
b.既能发生银镜反应,又能发生水解反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com