
【题目】锰是重要的合金材料和催化剂,在工农业生产和科技领域有广泛的用途。将废旧锌锰电池回收处理后,将含MnO2、MnOOH、Zn(OH)2及少量Fe的废料进行回收处理,能实现资源的再生利用。用该废料制备Zn和MnO2的一种工艺流程如图:

已知:Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
回答下列问题:
(1)还原焙烧过程中,MnOOH与炭黑反应,锰元素被还原为MnO,该反应的化学方程式为_____。
(2)滤渣1主要成分的化学式是________。
(3)净化阶段
①为了除掉滤渣2中的元素,选择最佳的加入试剂为______(填序号)。
A.氯水 B.O2 C.氨水 D.MnCO3
②已知:室温下,Ksp[Mn(OH)2]=10-13,Ksp[Fe(OH)3]=1×10-38,Ksp[Zn(OH)2]=10-17。净化时溶液中Mn2+、Zn2+的浓度约为0. 1mol·L-1,调节pH的合理范围是______。
(4)将MnO2和Li2CO3按4:1的物质的量比配料,混合搅拌,然后升温至600C~750°C, 制取产品LiMn2O4。写出该反应的化学方程式:________。
(5)LiMn2O4材料常制作成可充电电池(如图),该电池的总反应为![]()
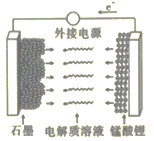
①充电时,锰酸锂为电池的_______(填“正极”“负极”“阴极”或“阳极”);该电极上发生的电极反应式为______________。
②该电池作为电源放电时,若电路中转移0.2mol e-,则石墨电极将减重____________。
【答案】2MnOOH+C![]() 2MnO+CO↑+H2O↑ C BD 3≤pH<5.5 8MnO2+2Li2CO3
2MnO+CO↑+H2O↑ C BD 3≤pH<5.5 8MnO2+2Li2CO3![]() 4LiMn2O4+2CO2↑+O2↑ 阳极 LiMn2O4-xe-== Li1-xMn2O4+xLi+ 1.4
4LiMn2O4+2CO2↑+O2↑ 阳极 LiMn2O4-xe-== Li1-xMn2O4+xLi+ 1.4
【解析】
含MnO2、MnOOH、Zn(OH)2及少量Fe的废料中加入过量炭黑,进行还原焙烧,生成CO、H2O、MnO、Fe、Zn等;再加入稀硫酸酸浸,滤渣1为C,滤液中含有FeSO4、ZnSO4、MnSO4等;净化时,需将Fe2+氧化为Fe3+,同时加入某试剂调节pH,将Fe3+转化为滤渣2,此时溶液中含有Mn2+和Zn2+;电解获得Zn和MnO2。
(1)还原焙烧过程中,MnOOH与炭黑反应,锰元素被还原为MnO,同时生成CO和水,该反应的化学方程式为2MnOOH+C![]() 2MnO+CO↑+H2O↑。答案为:2MnOOH+C
2MnO+CO↑+H2O↑。答案为:2MnOOH+C![]() 2MnO+CO↑+H2O↑;
2MnO+CO↑+H2O↑;
(2)焙烧所得固体中加入稀硫酸酸浸,只有炭黑不溶,所以滤渣1主要成分的化学式是C。答案为:C;
(3)①由以上分析知,滤渣2为Fe(OH)3,所以需加入氧化剂将Fe2+氧化为Fe3+,同时调节pH让其转化为沉淀,且尽可能不引入新的杂质,所以应选择最佳的加入试剂为BD。答案为:BD;
②当Fe3+完全转化为沉淀时,c(Fe3+)=1×10-5mol/L,利用Ksp[Fe(OH)3]=1×10-38,可求出pH=3;当净化时溶液中Mn2+、Zn2+的浓度约为0. 1mol·L-1,利用Ksp[Mn(OH)2]=10-13, Ksp[Zn(OH)2]=10-17,可求出pH=6、pH=8,由于pH高于5.5时Mn2+易被O2氧化,所以调节pH的合理范围是3≤pH<5.5。答案为:3≤pH<5.5;
(4)将MnO2和Li2CO3按4:1的物质的量比配料,混合搅拌,然后升温至600C~750°C, 制取产品LiMn2O4,则MnO2作氧化剂,同时应生成O2和CO2,该反应的化学方程式:8MnO2+2Li2CO3![]() 4LiMn2O4+2CO2↑+O2↑。答案为:8MnO2+2Li2CO3
4LiMn2O4+2CO2↑+O2↑。答案为:8MnO2+2Li2CO3![]() 4LiMn2O4+2CO2↑+O2↑;
4LiMn2O4+2CO2↑+O2↑;
(5)①充电时,从电子流动的方向看,锰酸锂失电子,为电池的阳极;该电极上发生的电极反应式为LiMn2O4-xe-== Li1-xMn2O4+xLi+。答案为:LiMn2O4-xe-== Li1-xMn2O4+xLi+;
②该电池作为电源放电时,发生反应为LixC+xe-==xLi+C,利用Li进行计算,若电路中转移0.2mol e-,则生成Li0.2mol,则石墨电极将减重0.2mol×7g/mol=1.4g。答案为:1.4。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】从铜氨废液含[Cu(NH3)3·CO]+、[Cu(NH3)2]2+、[Cu(NH3)4]2+、NH3、CH3COO-、CO32-等中回收铜的工艺流程如图:

(1)步骤(Ⅰ)“吹脱”的目的是___(写一条即可);由步骤(Ⅱ)可确定NH3与H+的结合能力比与Cu2+的___(填“强”或“弱”)。
(2)步骤(Ⅲ)“沉铜”时,Na2S的用量比理论用量多,目的是___。
(3)步骤(Ⅳ)反应中,氧化产物与还原产物的物质的量之比为___。
(4)步骤(Ⅵ)发生反应生成难溶Cu2(OH)3Cl的离子方程式为___,pH与铜的回收率关系如图(a)所示,为尽可能提高铜的回收率,需控制的pH约为___。
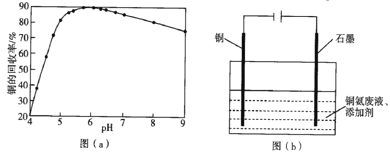
(5)“吹脱”后的铜氨溶液中加入适量的添加剂可直接电解回收金属铜,装置如图(b)所示,阴极主要发生的电极方程式为___;添加NaCl和H2SO4均可提高电导率和电流效率,从而提高铜的回收率,从环境角度考虑,较好的是___(填“NaCl”或“H2SO4”)。
(6)已知上述流程中只有步骤(Ⅲ)“沉铜”和步骤Ⅴ“制硫酸铜”中铜元素有损耗。步骤(Ⅲ)“沉铜”时铜元素的损耗率为4%;步骤Ⅴ“制硫酸铜”时铜元素损耗率为2%。若1L废液最终制得CuSO45H2O375g,则1L废液中含有铜元素的质量为___g。(保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮族元素在化学领域具有重要的地位。请回答下列问题:
(1)基态氮原子的价电子轨道表示式为__;第二周期的元素中,第一电离能介于B和N之间的元素有__种。
(2)雌黃的分子式为As2S3,其分子结构为![]() ,As原子的杂化类型为__。
,As原子的杂化类型为__。
(3)1mol 中所含σ键的物质的量为____mol。已知NF3与NH3分子的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,原因是__。
中所含σ键的物质的量为____mol。已知NF3与NH3分子的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,原因是__。
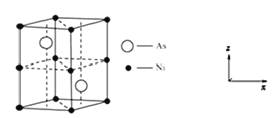
(4)红镍矿是一种重要的含镍矿物,其主要成分的晶胞如图所示,则每个Ni原子周围与之紧邻的As原子数为_____。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。磷化硼(BP)是一种超硬耐磨涂层材料,晶胞为正方体形,晶胞参数为apm。如图为沿y轴投影的晶胞中所有硼原子的分布图和原子分数坐标。设NA为阿伏伽德罗常数的值,1,2,3,4四点原子分数坐标分别为(0.25,0.25,0.75),(0.75,0.25,0.25),(0.25,0.75,0.25),(0.75,0.75,0.75)。据此推断BP晶体的密度为__gcm-3。(用代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) ΔH1=-748kJ·mol-1
2CO2(g)+N2(g) ΔH1=-748kJ·mol-1
2CO(g)+O2(g)===2CO2(g) ΔH2=-565kJ·mol-1
(1)在一定条件下N2和O2会转化为NO,写出该反应的热化学方程式:_________。
(2)为研究不同条件对反应的影响,在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.4mol CO,在催化剂存在的条件下发生反应,10min时反应达到平衡,测得10min内v(NO)=7.5×10-3mol·L-1·min-1,则平衡后n(CO)=________mol,关于该平衡的下列说法正确的是________。
a.增大压强,平衡一定向右移动
b.其他条件不变,升高温度,化学反应速率一定增大
c.其他条件不变,若改为在恒压容器中进行,CO的平衡转化率比恒容条件下大
d.达到平衡后v正(NO)=2v逆(N2)
(3)其他条件相同,t min时不同温度下测得NO的转化率如图所示。
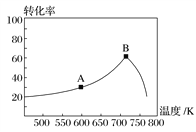
A点的反应速度v正________(填“>”、“<”或“=”)v逆,A、B两点反应的平衡常数较大的是________(填“A”或“B”)。
(4)已知HNO2的电离常数Ka=7.1×10-4mol·L-1;
NH3·H2O的电离常数Kb=1.7×10-5mol·L-1
则0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是____________________________,
常温下NO2-水解反应的平衡常数Kh=________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:
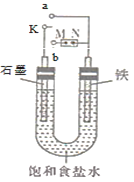
(1)若开始时开关K与a连接,则铁发生电化学腐蚀中的________腐蚀(填“吸氧”或“析氢”),正极发生的电极反应式为_______________。
(2)若开始时开关K与b连接,两极均有气体产生,则N端是电源的________极(填“正”或“负”),电解池总反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由1.3-丁二烯可制备醇酸树脂的原料M以及杀菌剂N,其合成路线如图:
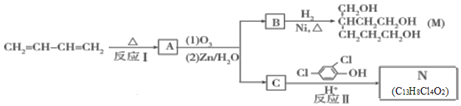
已知:i.Diels-AIder反应: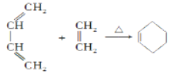
ii.RHC=CHR′![]() RCHO+ R′CHO(R、R′代表羟基或氢)
RCHO+ R′CHO(R、R′代表羟基或氢)
iii.A是一个六元环状化合物;lmol C能与2mol![]() 反应生成N。
反应生成N。
(1)N中含有的官能团名称为_______。
(2)CH2=CH—CH=CH2 能发生加聚反应生成顺式聚合物,请写出该顺式聚合物的结构简式:________。
(3)反应I的化学方程式是__________;该反应的反应类型为_________。
(4)lmol B完全转化成M所消耗的H2的质量是______g。
(5)反应II的化学方程式是________.
(6)A的某些同分异构体在相同的反应条件下也能生成B和C,写出其中一种同分异构体的结构简式:_____。
(7)已知:乙快与1, 3-丁二烯也能发生Diels-AIder反应。请以1, 3-丁二烯和乙炔为原料,选用必要的无机试剂合成丙二酸,写出合成路线________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用工业大理石(含有少量SiO2、Al2O3、Fe2O3等杂质)制取CaCl2·6H2O,设计了如下流程:
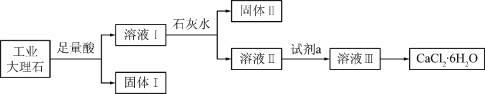
下列说法不正确的是
A. 固体I中含有SiO2,固体II中含有Fe(OH)3
B. 使用石灰水时,要控制pH,防止固体II中Al(OH)3转化为AlO2-
C. 试剂a选用盐酸,从溶液III得到CaCl2·6H2O产品的过程中,须控制条件防止其分解
D. 若改变实验方案,在溶液I中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2·6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,把下列各题的结果填在横线上
(1)0.0005 mol/L的氢氧化钡溶液的pH=____________
(2)pH=4的HNO3溶液中,水电离出的H+的物质的量的浓度c(H+)=___________mol·L-1
(3)pH=4的NH4Cl溶液中,水电离出的H+的物质的量的浓度c(H+)=___________mol/L
(4)pH相同的下列溶液:①盐酸、②醋酸,分别与足量且表面积相同的锌片反应,反应起始时生成气体的速率_______(选用“①快”或“②快”或“一样快”或“无法判断”填写),最终生成气体的体积_______。(选用“①多”或“②多”或“一样多”或“无法判断”填写)
(5)用离子方程式表示FeCl3溶液显酸性的原因:___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素(结构如图中I所示)是用途广泛的香料,由香豆素经下列图示的步骤可转变为水杨酸。
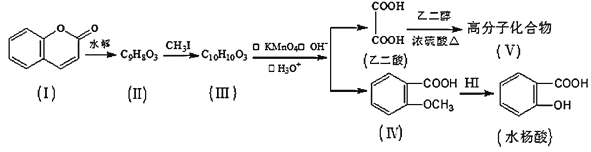
已知:CH3CH=CHCH2CH3![]() CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
请回答下列问题:
(1)香豆素分子中的官能团的名称为__,步骤Ⅱ→Ⅲ的反应类型为__。
(2)有机物III的结构简式为__,在上述转化过程中,设计反应步骤II→III的目的是__。
(3)下列关于有机物Ⅰ、Ⅱ、Ⅲ、Ⅳ的叙述中正确的是__(选填序号)。
A.可用FeCl3溶液来鉴别II和III
B.Ⅳ中核磁共振氢谱共有4种峰
C.Ⅰ、Ⅱ、Ⅲ均可使溴的四氯化碳溶液褪色
D.1molⅡ最多能和2molNaHCO3发生反应
(4)香豆素在过量NaOH溶液中完全水解的化学方程式为__。
(5)写出乙二酸和乙二醇(HOCH2CH2OH)生成Ⅴ的化学方程式为__。
(6)化合物Ⅳ有多种同分异构体,符合下列两个条件的芳香族同分异构体共有__种。
①遇FeCl3溶液发生显色反应;
②能发生水解反应和银镜反应。
其中,核磁共振氢谱共有5种吸收峰,且吸收峰面积比为1∶2∶2∶2∶1同分异构体的结构简式为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com