
【题目】常温下,下列溶液中各组离子一定能大量共存的是
A.使石蕊试液呈红色的溶液中:Na+、Al3+、NO3-、![]()
B.![]() =0.1 mol·L-1的溶液:Na+、K+、CO32-、NO3-
=0.1 mol·L-1的溶液:Na+、K+、CO32-、NO3-
C.含有0.1 mol·L-1 HCO3-的溶液:Na+、Fe3+、NO3-、SCN-
D.由水电离产生的c(H+)=10-12 mol·L-1的溶液:NH4+,SO42-、HCO3-、Cl-
科目:高中化学 来源: 题型:
【题目】雌黄(As2S3)在我国古代常用作书写涂改修正液。浓硝酸氧化雌黄可制得硫磺,并生成砷酸和一种红棕色气体,利用此反应原理设计为原电池。下列叙述正确的是( )
A.砷酸的分子式为H2AsO4
B.红棕色气体在该原电池的负极区生成并逸出
C.该反应的氧化剂和还原剂物质的量之比为10:1
D.该反应中每析出4.8g硫磺转移1mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:
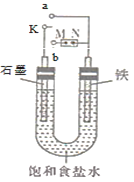
(1)若开始时开关K与a连接,则铁发生电化学腐蚀中的________腐蚀(填“吸氧”或“析氢”),正极发生的电极反应式为_______________。
(2)若开始时开关K与b连接,两极均有气体产生,则N端是电源的________极(填“正”或“负”),电解池总反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用工业大理石(含有少量SiO2、Al2O3、Fe2O3等杂质)制取CaCl2·6H2O,设计了如下流程:
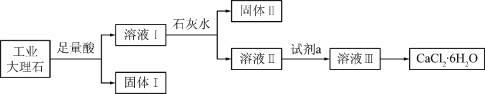
下列说法不正确的是
A. 固体I中含有SiO2,固体II中含有Fe(OH)3
B. 使用石灰水时,要控制pH,防止固体II中Al(OH)3转化为AlO2-
C. 试剂a选用盐酸,从溶液III得到CaCl2·6H2O产品的过程中,须控制条件防止其分解
D. 若改变实验方案,在溶液I中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2·6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2mol金属钠和1mol氯气反应的能量关系如图所示,下列说法不正确的是( )
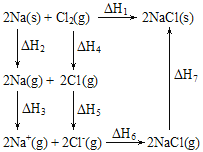
A.ΔH1=ΔH2+ΔH3+ΔH4+ΔH5+ΔH6+ΔH7
B.ΔH4的值数值上和Cl-Cl共价键的键能相等
C.ΔH7<0,且该过程形成了分子间作用力
D.ΔH5<0,在相同条件下,2Br(g)的ΔH5′>ΔH5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,把下列各题的结果填在横线上
(1)0.0005 mol/L的氢氧化钡溶液的pH=____________
(2)pH=4的HNO3溶液中,水电离出的H+的物质的量的浓度c(H+)=___________mol·L-1
(3)pH=4的NH4Cl溶液中,水电离出的H+的物质的量的浓度c(H+)=___________mol/L
(4)pH相同的下列溶液:①盐酸、②醋酸,分别与足量且表面积相同的锌片反应,反应起始时生成气体的速率_______(选用“①快”或“②快”或“一样快”或“无法判断”填写),最终生成气体的体积_______。(选用“①多”或“②多”或“一样多”或“无法判断”填写)
(5)用离子方程式表示FeCl3溶液显酸性的原因:___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解 NaHSO4 溶液制备 Na2S2O8(其中阴离子结构为![]() )。其中阴极材料为 Pb;阳极材料为铂。下列说法不正确的是
)。其中阴极材料为 Pb;阳极材料为铂。下列说法不正确的是
A.SO42-向阳极迁移
B.阳极可换为铜电极
C.阳极反应中 S 的化合价不变
D.阴极电极反应式:2H++2e-=H2↑。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸为一元弱酸,在15mL0.1mol/L KOH溶液中逐滴加入0.2mol/L甲酸溶液,溶液的pH变化和所加入的甲酸的体积关系描绘成如图所示曲线。下面有关微粒浓度的大小关系正确的是
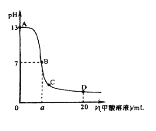
A. 在A、B间的任意一点上都存在:c(K+)>c(HCOO-)>c(OH-)>c(H+)
B. 在B点:c(K+)= c(HCOO-)>c(OH-)=c(H+),且a=7.5
C. 在C点:c(HCOO-)>c(K+)>c(H+)>c(OH-)
D. 在D点: c(HCOO-)+ c(HCOOH)=2 c(K+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa下,稀强酸与稀强碱溶液反应中和热为57.3kJ/mol。
(1)写出表示稀H2SO4与稀烧碱溶液反应的中和热的热化学方程式:___。
(2)学生甲用50mL0.25mol/L硫酸与50mL0.55mol/L烧碱溶液测定中和热装置如图。
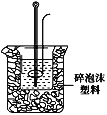
①实验时所需的玻璃仪器除烧杯、量筒外还需:__。
②该装置中有一处错误是:___。如果用该错误装置测定,测得的中和热ΔH会___(填“偏大、偏小、无影响”)。
③如果用60mL0.25mol/L硫酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热___(填“相等、不相等”)。
④若反应前溶液以及中和后的混合液的密度均设为1g/cm3,混合前酸与碱的温度均为t1,混合后溶液的温度为t2,比热容为4.18J/(g·℃),则中和热ΔH=___。
(3)学生乙用2mol/L的硫酸来测定与锌粒和锌粉反应的快慢,设计如图装置:
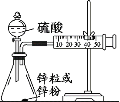
该生两次实验测定时间均设定为10min,则他还要测定的另一个数据是:___。
②若要减小产生H2的速率而又不影响产生H2的总量,应向硫酸中加入___(填字母)
a.Na2CO3溶液 b.K2SO4溶液 c.NaNO3溶液 d.水 e.CuSO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com