
����Ŀ����������(NOCl)���л��ϳ��е���Ҫ�Լ�����ҵ�Ͽ���NO��Cl2�ϳɡ��ش��������⣺
(1)��֪����2NO2(g)��NaCl(s)NaNO3(s)��NOCl(g) ��H1
��4NO2(g)��2NaCl(s) 2NaNO3(s)��2NO(g)��Cl2(g) ��H2
��2NO(g)��Cl2(g) 2NOCl(g) ��H3
���H3��_____________(�ú���H1����H2�Ĵ���ʽ��ʾ)��
(2)һ���¶��£���2L�ܱ������г���amol NOCl(g)��������Ӧ2NOCl(g)2NO(g)��Cl2(g)��
����֪������Ӧ������Ӧ���ʵı���ʽΪv����k��cn(NOCl)��300��ʱ���������Ӧ������NOCl��Ũ�ȵĹ�ϵ�����ʾ��
c(NOCl)/(mol/L) | v��/(molL-1s-1) |
0.20 | 1.6��10-9 |
0.40 | 6.4��10-9 |
0.60 | 1.44��10-8 |
n��______��k��_____L��mol��1��s��1����c(NOCl)��0.50 mol��L��1ʱ��v����_____mol��L��1��s��1��
�ڲ��NO�����ʵ���Ũ�����¶ȵĹ�ϵ��ͼ��ʾ(x<0.5a)��T1________T2(����>����<����������)��T2�¶��£��÷�Ӧ��ƽ�ⳣ��K��________mol��L��1(�ú�a��x�Ĵ���ʽ��ʾ)��
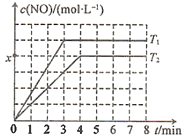
���𰸡�2��H1-��H2 2 4.0��10-8 1.0��10-8 > ![]()
��������
(1)��֪����2NO2(g)��NaCl(s)NaNO3(s)��NOCl(g) ��H1
��4NO2(g)��2NaCl(s) 2NaNO3(s)��2NO(g)��Cl2(g) ��H2
��2NO(g)��Cl2(g) 2NOCl(g) ��H3
���ø�˹���ɣ����������١��ڵĹ�ϵ���Ӷ������H3��
(2)��ͨ�������ڶ����������������һ�����ݵı�����ϵ�������n��k����c(NOCl)��0.50 mol��L��1ʱ�����빫ʽ�������v����
�ڶ���ƽ����ϵ���¶�Խ�ߣ���Ӧ����Խ�죬��ƽ���ʱ��Խ�̣��ɴ�ȷ��T1��T2�Ĵ�С��ϵ��T2�¶��£��ӱ�����ȡ���ݣ�������÷�Ӧ��ƽ�ⳣ��K��
(1)��֪����2NO2(g)��NaCl(s)NaNO3(s)��NOCl(g) ��H1
��4NO2(g)��2NaCl(s) 2NaNO3(s)��2NO(g)��Cl2(g) ��H2
��2NO(g)��Cl2(g) 2NOCl(g) ��H3
���ø�˹���ɣ���Ӧ��=2����-�ڣ��Ӷ������H3=2��H1-��H2����Ϊ��2��H1-��H2��
(2)�ٴӱ��вɼ�ǰ�������ݣ����빫ʽ������![]() ���Ӷ����n=2��
���Ӷ����n=2��
��n=2���빫ʽ���ɵ�1.6��10-9=k��0.202���Ӷ����k=4.0��10-8����c(NOCl)��0.50 mol��L��1ʱ�����빫ʽ�������v��=4.0��10-8��0.502=1.0��10-8 mol��L��1��s��1����Ϊ��2��4.0��10-8��1.0��10-8
�ڶ���ƽ����ϵ���¶�Խ�ߣ���Ӧ����Խ�죬��ƽ���ʱ��Խ�̣��ɴ�ȷ��T1>T2��T2�¶��£��ӱ�����ȡ���ݣ�������������ʽ��

������÷�Ӧ��ƽ�ⳣ��K=![]() =
=![]() ������>��
������>��![]() ��
��


 С��ſ�ʱ��ҵϵ�д�
С��ſ�ʱ��ҵϵ�д� һ������ϵ�д�
һ������ϵ�д� �Ƹ�С״Ԫ���ֳ������ϵ�д�
�Ƹ�С״Ԫ���ֳ������ϵ�д� �¸��̵�ѧϵ�д�
�¸��̵�ѧϵ�д� ����ͬѧһ����ʦȫ�źþ�ϵ�д�
����ͬѧһ����ʦȫ�źþ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪NA�ǰ����ӵ�������ֵ������˵����ȷ����
A.18 g 18O���е�������Ϊ8NA
B.0.1 mol H2C2O4������ΪCO2ת�Ƶĵ�����Ϊ0.1NA
C.��״���£�a L�����͵������Ѻ����к��е�ԭ������ԼΪ![]() NA
NA
D.�����¡���1 mol H2SO4��Ũ����������ͭ��Ӧ��ת�Ƶĵ�����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ת���ڸ�����������ʵ�ֵ��ǣ� ��
��![]()
��![]()
��![]()
��![]()
��![]()
A.�٢ڢ�B.�ڢۢ�C.�٢ۢ�D.�ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�������μӵ�Na2X��Һ�У������Һ��pOH[pOH=��lgc(OH-)]������Ũ�ȱ仯�Ĺ�ϵ��ͼ��ʾ��

����������ȷ����
A. ����N��ʾpOH��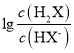 ���ߵı仯��ϵ
���ߵı仯��ϵ
B. NaHX��Һ��c(X2-)>c(H2X)
C. �������Һ������ʱ��c(Na+)=c(HX-)+2c(X2-)
D. �����£�Na2X�ĵ�һ��ˮ�ⳣ��Kh1=1.0��10-4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����̶����ܱ������У�ij��ѧ��Ӧ2A(g)![]() B(g)��D(g)�����ֲ�ͬ�����½��У�B��D��ʼŨ��Ϊ0����Ӧ��A��Ũ��(mol��L��1)�淴Ӧʱ��(min)�ı仯��������
B(g)��D(g)�����ֲ�ͬ�����½��У�B��D��ʼŨ��Ϊ0����Ӧ��A��Ũ��(mol��L��1)�淴Ӧʱ��(min)�ı仯��������
ʵ����� | �¶� | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
�����������ݣ����������գ�
(1)ʵ��1�У���10��20min�ڣ���A��ʾ�ĸ÷�Ӧ��ƽ������Ϊ________mol��L��1��min��1��
(2)ʵ��2��c2��________����Ӧ��20min�ʹﵽƽ�⣬���Ʋ�ʵ��2�л�������������________��
(3)��ʵ��3�ķ�Ӧ����Ϊv3��ʵ��1�ķ�Ӧ����Ϊv1����v3______(����>����<��������������ͬ)v1����c3_____1.0��
(4)���������ʵ��ָ��Ҫ�ӿ�÷�Ӧ���ʿɲ�ȡ�ķ�����________��(�����о�2�ַ���)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��
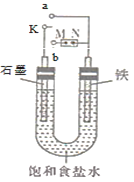
(1)����ʼʱ����K��a���ӣ����������绯ѧ��ʴ�е�________��ʴ(��������������������)�����������ĵ缫��ӦʽΪ_______________��
(2)����ʼʱ����K��b���ӣ��������������������N���ǵ�Դ��________��(����������������)�������ܷ�Ӧ�����ӷ���ʽΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����C=C�����ʣ�ϩ����һ������������ˮ�����ӳɷ�Ӧ�����ɴ������ǻ���������������л���A-D�����ͼʾ��ת����ϵ������˵������ȷ����
![]()
A.D�ṹ��ʽΪCH3COOCH2CH3B.A��ʹ���Ը��������Һ��ɫ
C.B�����ᷢ����ȡ����ӦD.����B��ȡ��ˮ�еĵⵥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2mol�����ƺ�1mol������Ӧ��������ϵ��ͼ��ʾ������˵������ȷ���ǣ� ��
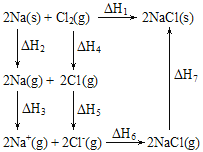
A.��H1=��H2+��H3+��H4+��H5+��H6+��H7
B.��H4��ֵ��ֵ�Ϻ�Cl-Cl���ۼ��ļ������
C.��H7<0���Ҹù����γ��˷��Ӽ�������
D.��H5<0������ͬ�����£�2Br(g)����H5��>��H5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������и�����������Һ�У�һ���ܴ���������������ǣ� ��
A.ʹpH��ֽ������ɫ����Һ��Ca2+��NH4+��HCO3-��Cl-
B.�����£�![]() =0.1mol/L����Һ��Na+��K+��SiO32-��NO3-
=0.1mol/L����Һ��Na+��K+��SiO32-��NO3-
C.��FeCl3����Һ��K+��Na+��SO42-��CO32-
D.�����������Ӧ�ų���������Һ��Mg2+��Na+��SO42-��Cl-
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com