
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂被誉为“高能金属”,是锂离子电池的电极材料。工业上常用β锂辉矿(主要成分为Li2O·Al2O3·4SiO2以及少量钙、镁杂质)和氟磷灰石(Ca5P3FO12)为原料制取锂离子电池正极材料LiFePO4,工艺流程如图:
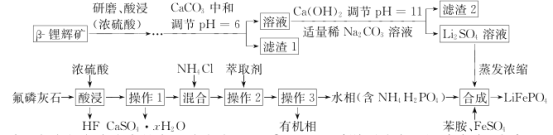
已知:①残留在溶液中的离子浓度小于10-5 mol·L-1 说明该离子沉淀完全;
②常温下,Ksp[Al(OH)3]=2.7×10-34、Ksp[Mg(OH)2]= 1.2×10-1 ;
③LiFePO4难溶于水。
回答下列问题:
(1)氟磷灰石(Ca5P3FO12 )中磷元素的化合价为______ , 滤渣2的主要成分是______(写化学式)。
(2)操作I所需的玻璃仪器名称有烧杯____________,操作 3的名称是_____________。
(3)蒸发浓缩Li2SO4溶液的目的是_____________________。
(4)写出合成反应的离子方程式:____________________________________。
(5)一种锂离子电池的反应原理为LiFePO4![]() Li+FePO4。写出放电时正极电极反应式:_____________________________。
Li+FePO4。写出放电时正极电极反应式:_____________________________。
(6)若某企业制备110.6 t纯净的LiFePO4,需要300t含氧化锂5%的β锂辉矿石,则锂元素的利用率为__________________。
【答案】+5; Mg(OH)2,CaCO3 漏斗、玻璃棒 分液 增大溶液中Li+浓度,便于生成LiFePO4 Li++Fe2++H2PO4-= LiFePO4↓+2H+ FePO4+ Li++e-=LiFePO4 70%
【解析】
根据Ksp[Al(OH)3]=2.7×10-34,残留在溶液中的离子浓度小于10-5 mol·L-1,说明该离子沉淀完全,可计算铝离子完全沉淀的pH;计算过程如下:2.7×10-34=10-5 mol·L-1×![]() ,解得c(OH-)=3×10-10 mol·L-1,c(H+)=
,解得c(OH-)=3×10-10 mol·L-1,c(H+)=![]() =10-4.7,pH=4.7;同理Mg2+完全沉淀的pH=11.1,故第一步调pH=6后,Al3+已经形成沉淀,Mg2+未形成沉淀,所以滤渣1为SiO2和Al(OH)3,滤渣2为Mg(OH)2,CaCO3;Li2SO4溶液中还有一定的杂质Na+,据此解答。
=10-4.7,pH=4.7;同理Mg2+完全沉淀的pH=11.1,故第一步调pH=6后,Al3+已经形成沉淀,Mg2+未形成沉淀,所以滤渣1为SiO2和Al(OH)3,滤渣2为Mg(OH)2,CaCO3;Li2SO4溶液中还有一定的杂质Na+,据此解答。
(1)化合物中,化合价代数和为0,设P的化合价为x,则有(+2)×5+x×3+(-1)×1+(-2)×12=0,解得x=+5;由上面的分析可知,滤渣2主要还有Mg(OH)2,CaCO3,故答案为:+5;Mg(OH)2,CaCO3;
(2)操作1为过滤,所需的玻璃仪器名称有烧杯、漏斗、玻璃棒;操作2为萃取,操作3得到水相和有机相,因此为分液,故答案为:漏斗、玻璃棒;分液;
(3)蒸发浓缩Li2SO4,增大了溶液中Li+浓度,便于生成LiFePO4,故答案为:增大溶液中Li+浓度,便于生成LiFePO4;
(4)从合成前后的物质元素分析来看,所有元素化合价都未变化,为简单的离子反应,离子方程式为:Li++Fe2++H2PO4-=LiFePO4↓+2H+,故答案为:Li++Fe2++H2PO4-=LiFePO4↓+2H+;
(5)放电时工作原理为原电池原理,正极得电子,化合价降低,被还原,电极反应式为:FePO4+ Li ++e-=LiFePO4,故答案为:FePO4+ Li ++e-=LiFePO4;
(6)300t含氧化锂5%的锂辉矿石中Li2O的质量=300t×5%=15t,根据锂原子守恒Li2O和LiFePO4的关系式为Li2O~2LiFePO4计算如下![]() ,实际得到110.6t,则利用率=
,实际得到110.6t,则利用率=![]() ×100%=70%,故答案为:70%。
×100%=70%,故答案为:70%。


科目:高中化学 来源: 题型:
【题目】下列离子的检验方法一定正确的是( )
A.向某溶液中滴加![]() 溶液,有白色沉淀,再滴加足量稀
溶液,有白色沉淀,再滴加足量稀![]() ,若沉淀不溶解,则原溶液中一定含
,若沉淀不溶解,则原溶液中一定含![]()
B.向某溶液中滴加![]() 溶液,若出现红色则原溶液中含
溶液,若出现红色则原溶液中含![]()
C.向某溶液中滴加足量稀盐酸,产生气体使澄清石灰水变浑浊,则原溶液中含![]()
D.用铂丝蘸取某溶液在酒精灯火焰上灼烧,未观察到紫色火焰,则原溶液中不含![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
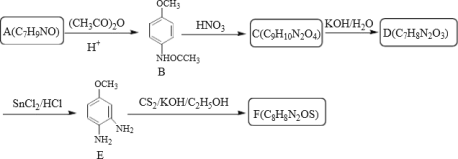
【题目】奥美拉唑主要用于十二指肠溃疡和胃溃的治疗,静脉注射可用于消化性溃疡急性出血的治疗,反应中间体F和奥美拉唑的合成路线如图:
I>中间体F的合成:
II.奧美拉唑的合成:
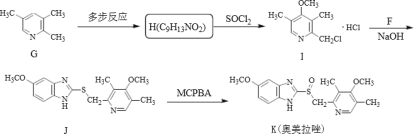
已知:R-OH![]() R-Cl
R-Cl
R1-SH+R2-X![]() R1-S-R2
R1-S-R2
结合上述合成路线,请回答:
(1)下列说法正确的是_____。
A.奥美拉唑的分子式为C18H19N3O3S
B.J生成K的反应类型为加成反应
C.化合物C可以发生的反应类型有取代、还原、加成
D.设计A转化为B的目的是保护其中的官能团
(2)化合物F的结构简式为_____;
(3)请写出A→B的反应方程式_____;
(4)试写出同时满足下列条件的化合物H的同分异构体:_____。
①分子中含苯环,遇FeC13显紫色
②分子中含有4种不同化学环境的氢原子。
(5)利用已有知识和题中涉及的反应,设计从乙烯合成![]() 的路线_____。(用流程图表示,无机试剂任选)
的路线_____。(用流程图表示,无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值,下列有关叙述正确的是()
A.将78gNa2O2与过量CO2反应转移的电子数为2NA
B.1molN2与4molH2反应生成的NH3分子数为2NA
C.标准状况下,2.24LSO3中所含原子数为0.4NA
D.标准状况下,18gD2O中所含电子数为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于_______变化,钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择_______(选填“铜块”、“锌块”、“铅块”);
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:

请回答下列问题:
①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为_______;
②实验室常采用_______操作进行沉淀分离;
③生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是_______;
④高纯氧化钙生产过程中,“干燥”的主要目的是为了防止______(用化学方程式表示);
(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少_______污染,20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用______方法区分尼龙和蚕丝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO是重要化学物质。回答下列问题:
(1)工业生产硝酸时,首先氨氧化反应制备NO,写出该反应的化学方程式:_____________。
(2)工厂排放尾气中NO可用催化剂[La0.8A0.2BCoO3+x(A.B均为过渡元素)]脱除。研究表明,一定温度下,NO的脱除率与还原剂(如H2)、催化剂以及催化剂表面氧缺位(※)的密集程度有关。催化机理如下:
第一阶段:B4+(不稳定)+H2→低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:NO(g)+※→NO(吸附态) H1、K1
2NO(吸附态)→2N(吸附态)+O2(g) △H2、K2
2N(吸附态)→N2(g)+2※ △H3、K3
2NO(吸附态)→N2(g) +2O(吸附态) H4、K4
2O(吸附态)→O2(g)+2※ △H5、K5
①第一阶段用H2还原B4+得到低价态的金属离子越多,第二阶段反应的速率越快,其原因是__________________________________。
②根据第二阶段可知,能量大小:NO(g)__________(填“>”“=”或“<”)NO(吸附态)。
③该温度下,NO脱除反应2NO(g)![]() N2(g)+ O2(g)的平衡常数K=_____(用K1、K4、K5的表达式表示)。
N2(g)+ O2(g)的平衡常数K=_____(用K1、K4、K5的表达式表示)。
(3)物质的生成热是指最稳定的单质合成1mol该物质所放出的热量(H);单质的生成热均为0。已知NO(g)、CO(g)、CO2(g)的生成热分别为90.4kJ·mol-1、l10kJ·mol-1、393 kJ·mol-1。则一定条件下,NO(g)与CO(g)反应2NO(g) + 2CO(g)![]() N2(g)+2CO2(g)的△H=_____。
N2(g)+2CO2(g)的△H=_____。
(4)在2 L恒容密闭容器中充入4 mol CO和4 mol NO,发生反应2NO(g) +2CO(g)![]() N2(g)+ 2CO2(g),平衡时,NO的体积分数与温度(℃)、压强(Pa)的关系如图所示。
N2(g)+ 2CO2(g),平衡时,NO的体积分数与温度(℃)、压强(Pa)的关系如图所示。
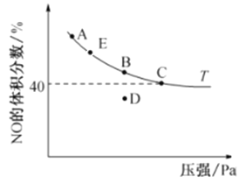
①C点NO的平衡转化率为______;若C点在10 min达到平衡,则10 min内CO的平均反应速率为________。
②若起始容器内压强为力P,则C点时该反应的平衡常数Kp=____ (用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
③若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是________________(从图中A、B、C、E点选填)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固氮作用有3种途径:生物固氮、人工固氮和大气固氮。如表列举了不同温度下大气固氮的部分平衡常数K值。![]() 时,向
时,向![]() 的恒容密闭容器中充入
的恒容密闭容器中充入![]() 和
和![]() ,10s时反应达到平衡。
,10s时反应达到平衡。
反应 | 大气固氮 | |
温度/℃ | 27 | 2260 |
K |
| 1 |
下列说法正确的是( )
A.大气固氮反应属于放热反应
B.10 s末,![]() 的转化率约为
的转化率约为![]()
C.10 s内,用![]() 表示的平均反应速率为
表示的平均反应速率为![]()
D.10 s末,再向容器中充入![]() mol
mol ![]() 和
和![]() mol
mol ![]() ,
,![]() 的平衡转化率不变
的平衡转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。Fe在元素周期表中的位置为__________。科学家在研究金属矿物质组分的过程中。发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体的方法是_____________。
②已知:r(Fe2+)为61 pm,r(Co2+)为65 pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是_______。
③下表是Fe和Cu的部分电离能数据,请解释I2(Cu)大于I2(Fe)的主要原因是__。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第一电离能I2/kJ·mol-1 | 1561 | 1958 |
(2)原子序数依次增大的五种元素A、B、C、D、E分别处于第一至第四周期,A是前四周期中原子半径最小的元素,B原子核外电子有6种不同的运动状态,常温下C的单质是空气中含量最多的成份,D最高价氧化物对应水化物的酸性最强,E的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
①B2A2的电子式是___,D所在主族的前四种元素分别与A形成的化合物,其共价键的极性由强到弱的顺序是___(填化学式)。
②A和C形成的简单化合物遇到D单质出现白烟现象,写出有关反应的化学方程式为____。
③向E的硫酸盐溶液中滴加过量氨水,观察到的现象是首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,请写出最后-步得到深蓝色透明溶液对应的离子方程式____。
(3)金属镓有“电子工业脊梁“的美誉,镓及其化合物应用广泛。砷化镓是半导体材料属立方晶系,其晶胞结构如图所示。
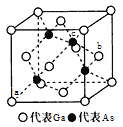
①晶胞中,与Ga原子等距离且最近的As原子形成的空间构型为____。
②原子坐标参数是晶胞的基本要素之-,表示晶胞内部各原子的相对位置,图中a(0,0,0)、b(1,![]() ,
,![]() ),则c原子的坐标参数为_____。
),则c原子的坐标参数为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将亚磷酸氢二钠(Na2HPO3)溶液通过电渗析法来制备亚磷酸(H3PO3)的原理如图所示,下列有关说法错误的是

A.阳极的电极反应式为2H2O-4e-=4H++O2↑
B.在原料室与产品室间设计缓冲室的主要目的是提高产品的纯度
C.阴极的电极反应式为2H2O+2e-=2OH-+H2↑
D.膜①、③、④均为阳离子交换膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com