
【题目】常温下,2NH3(g)+NaClO(aq)=NaCl(aq)+N2H4(aq)+H2O(l)能自发进行,可用于生产N2H4。下列有关说法正确的是
A.该反应的△H>0,△S<0
B.每生成1mol N2H4转移2mol电子
C.室温下,向0.lmol/L NaClO溶液中加水,溶液pH增大
D.N2H4、O2和KOH溶液组成的燃料电池,负极反应为![]()
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】T℃时,分别向10 mL浓度均为0.1 mol·L-1的CuCl2和ZnCl2溶液中滴加0.1 mol·L-1的Na2S溶液,滴加过程中-lgc(Cu2+)和-lgc(Zn2+)与Na2S溶液体积(V)的关系如图所示[已知:Ksp(ZnS)>Ksp(CuS),lg3≈0.5]。下列有关说法错误的是( )。
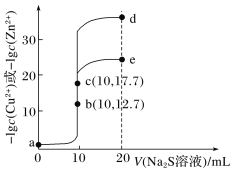
A.a~b~d为滴定ZnCl2溶液的曲线
B.对应溶液pH:a<b<e
C.a点对应的CuCl2溶液中:c(Cl-)<2[c(Cu2+)+c(H+)]
D.d点纵坐标约为33.9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________(用对应的元素符号表示);基态D原子的电子排布式为_____。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取________杂化;BC![]() 的立体构型为________(用文字描述)。
的立体构型为________(用文字描述)。
(3)1 mol AB-中含有的π键个数为________,电子式为__________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比________。
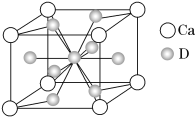
(5)镍元素的原子价电子排布式为_____________________.
镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________________(填数值);氢在合金中的密度为_____________。(写出表达式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL的某稀盐酸中滴入0.1 mol·L-1的羟胺溶液, 羟胺的电离方程式为:NH2OH+H2O ![]() NH3OH++OH-(25℃常温时, Kb=9.0×l0-9)。溶液中由水电离出的氢离子浓度随滴入羟胺溶液体积的变化如图(已知:lg3=0.5),下列分析正确的是
NH3OH++OH-(25℃常温时, Kb=9.0×l0-9)。溶液中由水电离出的氢离子浓度随滴入羟胺溶液体积的变化如图(已知:lg3=0.5),下列分析正确的是
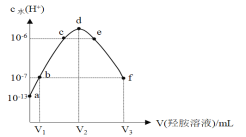
A.0.1 mol·L-1羟胺溶液的 pH=8.5B.b点溶液中:c(H+) =c(OH-)
C.d点对应溶液中存在:c(H+)=c (OH-)+c (NH2OH)D.该稀盐酸的浓度为0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制溴苯的装置图。完成下列填空:

(1)该反应的化学方程式:___。
(2)双球U形管中盛放CCl4的用途:___。
(3)A中铁丝的作用:___。
(4)分液漏斗中液体滴入A中的实验现象___。
(5)若A中混合液倒入冷水,则有黄色液体产生,原因是溴苯中混有___ (填化学式),如何除去该杂质需加入的试剂是___,相应操作为___。
(6)B试管中若加入硝酸银溶液,则实验现象是:___。加入硝酸银溶液的目的是为了检验___(填化学式)的生成,从而证明该反应为___(填反应类型)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBH4是一种常见的还原剂。一种以H2、Na、硼酸三甲酯[B(OCH3)3]为原料,生产NaBH4的工艺流程如下:
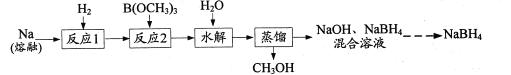
(1)下列措施能提高“反应1”的化学反应速率的有______(填字母)。
A.充分搅拌熔融钠
B.将熔融钠充分分散在石蜡油中
C.反应前排尽装置中的空气
(2)在浓硫酸作用下,B(OCH3)3可由B(OH)3和CH3OH发生酯化反应制得。浓H2SO4的作用是_____。
(3)“反应2”在240℃条件下进行,生成的产物是NaBH4和CH3ONa,写出该反应的化学方程式:____ 。“反应2”所用B(OCH3)3需充分干燥,原因是______。
(4)反应NaBH4+2H2O=NaBO2+4H2 可用于制取H2。一定浓度的NaBH4催化制氢的半衰期(溶液中NaBH4消耗一半时所需的时间)与溶液pH的关系如图所示:
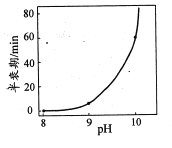
①NaBH4与水反应所得溶液呈碱性,原因是____。
②随着反应的进行,生成H2的速率逐渐减慢,原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——有机化学基础)
聚酰胺—66常用于生产帐篷、渔网、降落伞及弹力丝袜等织物,可利用下列路线合成:

已知反应:![]()
(1)能与银氨溶液反应的B的同分异构体的结构简式为_________________,
(2)D的结构简式为____________,①的反应类型为_____________,
(3)为检验D中的官能团,所用试剂包括NaOH水溶液及___________,
(4)由F和G生成H的反应方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3O4中含有Fe2+、Fe3+,分别表示为 Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用 H2消除酸性废水中的致癌物 NO2-,其反应过程示意图如图所示,下列说法不正确的是
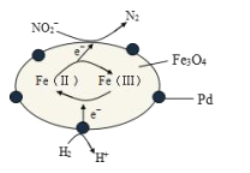
A.用该法处理后水体的 pH降低
B.Fe(Ⅱ)与 Fe(Ⅲ)的相互转化起到了传递电子的作用
C.反应过程中NO2-被 Fe(Ⅱ)还原为 N2
D.Pd 上发生的电极反应为:H2- 2e-== 2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
(1)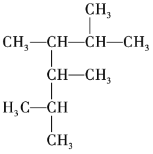 的名称为______。
的名称为______。
(2) 的名称为______。
的名称为______。
(3)3-甲基-2-戊烯的结构简式为______。
(4)1,3,5-三甲基苯的结构简式为______。
(5)某烷烃的相对分子质量为72,其一氯代物只有一种,该烷烃的结构简式为______。
(6)2,3-二甲基-2-丁烯的键线式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com