
【题目】鉴别氯水和盐酸最合适的试剂是
A. AgNO3溶液 B. 淀粉碘化钾溶液
C. Na2CO3溶液 D. 酚酞试液
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的
A. 硫酸铵溶液中加入浓氢氧化钠溶液并加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
B. 碳与浓硝酸反应:C+4H++NO3-=CO2↑+2NO↑+2H2O
C. 氨水与FeCl3反应:3OH-+Fe3+=Fe(OH)3↓
D. 向NH4Al(SO4)2溶液中滴入Ba(OH)2使SO42-恰好完全反应:2Ba2++4OH-+Al3++2SO42-=BaSO4↓+AlO2-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是

A. 31d和33d属于同种核素
B. 气态氢化物的稳定性:a>d>e
C. b、c的最高价氧化物对应水化物可以反应
D. a和b形成的化合物不可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸与强碱的稀溶液发生中和反应的热效应为H+(aq)+OH(aq)![]() H2O(l) ΔH=57.3 kJ/mol。稀醋酸、浓硫酸、稀硝酸分别与0.1 mol·L1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示(CH3COOH电离要吸热)。则下列描述正确的是
H2O(l) ΔH=57.3 kJ/mol。稀醋酸、浓硫酸、稀硝酸分别与0.1 mol·L1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示(CH3COOH电离要吸热)。则下列描述正确的是
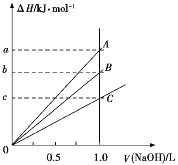
A.A表示稀硝酸与NaOH溶液的反应
B.B表示稀醋酸与NaOH溶液的反应
C.b=5.73
D.C表示浓硫酸与NaOH溶液的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:

回答下列问题:
(1)NaClO2中Cl的化合价为_________;
(2)写出“反应”步骤中生成ClO2的化学方程式________________________;
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、_______________;
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2,此吸收反应中,氧化剂与还原剂的物质的量之比为__________________,该反应中氧化产物是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气、铝、铁都是重要的还原剂,已知下列反应的热化学方程式,下列关于反应的焓变判断正确的是
2H2(g)+O2(g)===2H2O(g) △H1
3H2(g)+Fe2O3(s)===2Fe (s)+ 3H2O(g) △H2
2Fe(s)+ 3/2O2(g)===Fe2O3(s) △H3
2Al(s)+3/2O2(g)===Al2O3(s) △H4
2Al(s)+ Fe2O3(s)===Al2O3(s)+2Fe(s) △H5
A. △H1<0;△H3>0 B. △H5<0;△H4<△H3
C. △H1=△H2+△H3 D. △H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用浓度相同的氯水、Cl2的CCl4溶液完成下述实验。下列有关实验的说法中,不正确的是
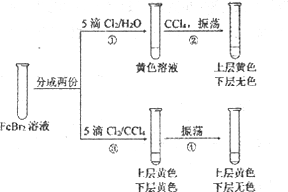
A. 操作④中发生的反应是Br2+ 2Fe2+=2Br-+2Fe3+
B. 操作②和操作④之后,试管上层溶液的成分相同
C. 操作①后的溶液中没有Br2,但反应过程中可能有Br2生成
D. 实验说明,CCl4影响了Cl2、Br2和Fe3+氧化性的强弱顺序
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:
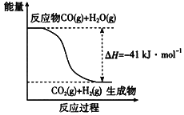
反应的热化学方程式为____________________________________________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0kJ·mol-1,N-H键的键能是391.55kJ·mol-1,则![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g) ΔH=______________。
NH3(g) ΔH=______________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:①C(s,石墨)+O2(g)![]() CO2(g) ΔH1=-393.5kJ·mol-1
CO2(g) ΔH1=-393.5kJ·mol-1
②2H2(g)+O2(g)![]() 2H2O(l) ΔH2=-571.6kJ·mol-1
2H2O(l) ΔH2=-571.6kJ·mol-1
③2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) ΔH3=-2599kJ·mol-1
4CO2(g)+2H2O(l) ΔH3=-2599kJ·mol-1
298K时反应2C(s,石墨)+H2(g)![]() C2H2(g)的焓变:ΔH=_______________。
C2H2(g)的焓变:ΔH=_______________。
(4)已知:铝热反应是放热反应,又知,常温下:
4Al(s)+3O2(g)![]() 2Al2O3(s) ΔH1
2Al2O3(s) ΔH1
4Fe(s)+3O2(g)![]() 2Fe2O3(s) ΔH2
2Fe2O3(s) ΔH2
下面关于ΔH1、ΔH2的比较正确的是________
A.ΔH1>ΔH2 B.ΔH1<ΔH2 C.ΔH1=ΔH2 D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 用电子式表示氯化氢分子的形成过程:![]()
B. 二氧化硅熔点高于二氧化碳是因为其分子间作用力更大
C. 吸热反应一定要加热才能发生
D. 需要加热才能发生的反应不一定是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com