
【题目】常温下,下列各组离子在指定环境中一定能大量共存的是( )
A. pH=1的无色溶液SO42-、Cu2+、Na+、Cl-
B. 使石蕊试纸变蓝的溶液:Na+、K+、S2-、 CO32-
C. 加入铝粉能产生H2的溶液中: NH4+、Na+、Fe2+、 NO3-
D. 水电离出的c(H+)=1.0× ![]() mol/L的溶液中:K+、Na+、Cl-、 HCO3-
mol/L的溶液中:K+、Na+、Cl-、 HCO3-
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】将甘油(C3H8O3)转化成高附加值产品是当前热点研究方向,甘油和水蒸气经催化重整可制得氢气,反应主要过程如下:
反应Ⅰ: C3H8O3(l)+3H2O(g)![]() 3CO2(g)+7H2(g) ΔH1
3CO2(g)+7H2(g) ΔH1
反应Ⅱ: 2C3H8O3(l)+3O2(g)![]() 6CO2(g)+8H2(g) ΔH2=a kJ·mol-1
6CO2(g)+8H2(g) ΔH2=a kJ·mol-1
反应Ⅲ: 2H2(g)+O2(g)![]() 2H2O(g) ΔH3=b kJ·mol-1
2H2O(g) ΔH3=b kJ·mol-1
(1)ΔH1=__________。
(2)酸性条件下,甘油可在纳米TiO2Pt复合膜阳极上转化为甘油醛(C3H6O3),该电极方程式为________________________________。
(3)硝化甘油(C3H5O9N3)是治疗心绞痛的速效药,也可用作开采矿物的炸药。
①硝化甘油能治疗心绞痛的原理是在人体中释放NO,实验室中也可通过干法制备NO,方程式为3KNO2+KNO3+Cr2O3![]() 2K2CrO4+4NO↑。若有1 mol NO生成,则被KNO3氧化的Cr2O3的物质的量为________mol。
2K2CrO4+4NO↑。若有1 mol NO生成,则被KNO3氧化的Cr2O3的物质的量为________mol。
②硝化甘油爆炸时会彻底分解为N2、O2、CO2和H2O,反应的化学方程式为__________________________________________。
(4)①反应Ⅰ制备H2时的副产物很多,主要有CH4、C2H4等,生产过程中必须采取措施抑制副产物产生,目的是__________________________________________________________。
②为了有效提高反应Ⅰ氢气的产率,研究人员还采用CaO吸附增强制氢的方法。如图1所示,请分析加入CaO提高氢气产率的原因_________________________________________。

(5)高效的催化剂是这种制氢方法能大规模应用的重要因素。图2为三种不同催化剂在一段时间内与甘油转化率的关系,则Ni/SiC催化剂的优点是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分。
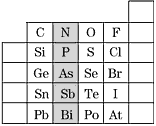
(1)上图中元素N在元素周期表中的位置为_________________,根据元素周期律,请预测H3AsO4、H3PO4的酸性强弱:H3AsO4________H3PO4(填“强于”或“弱于”)。
(2)上图中元素O、S、Se的氢化物的沸点由高到低为:________>________>________。(用化学式填写)_____________
(3)写出S2-的离子结构示意图为______________;判断表中Bi和Te两种元素的金属性强弱:Bi________Te(填“<”或“>”或“=”)。
(4)Br2具有较强的氧化性,SO2具有较强的还原性,请写出将SO2气体通入溴水中反应的离子方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素是一种重要的氮肥,它的合成主要发生以下2步反应:
反应1:2NH3(g)+CO2(g) ![]() NH4COONH2(1) △H1=a kJ·mol-1
NH4COONH2(1) △H1=a kJ·mol-1
反应2:NH4COONH2(1)=====NH2CONH2(1)+H2O(1) △H2=b kJ·mol-1
回答下列问题:
(1)写出合成尿素的热化学方程式:_____________________(用含a、b的代数式表示)。写出一种可以提高NH3平衡转化率的措施:_______________________________。
(2)95℃时,在2L恒容密闭容器中加入3mol氨气和1molCO2使之充分反应合成尿素,达到平衡时,CO2的转化率为60%,则此温度下合成尿素的平衡常数是________________(保留2位小数)。
(3)下表为反应1和反应2在不同温度下达到平衡时所测得的平衡常数(K)的数据。

①从上表数据可推出b_____(填“>”或“<”)0,理由是______________________。
②升高温度,反应1的反应速率将_________(填“增大”或“减小”)。
③下图是合成尿素时温度对二氧化碳转化率的影响曲线。从图中可知A、B、C三点对应的温度下该反应的平衡常数大小关系是_________________(用KA、KB、KC表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述正确的是
①化学键只存在于分子之间
②化学键是相邻原子之间强烈的相互作用
③化学键是一种静电作用
④化学键是相邻分子之间强烈的相互吸引
⑤离子化合物中可能含有共价键
⑥共价化合物中可能含有离子键
⑦离子化合物中只含离子键
⑧共价化合物中不含离子键
A.②③④⑦B.②③⑤⑧
C.②④⑤⑥D.①③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取O2和Cl2的化学反应方程式分别为①2KClO3 ![]() 2KCl+3O2↑;②MnO2+4HCl(浓)
2KCl+3O2↑;②MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,则下列说法正确的是( )
MnCl2+Cl2↑+2H2O,则下列说法正确的是( )
A. 均为氧化还原反应
B. ②中MnO2为还原剂
C. ①中反应前后MnO2质量不发生变化
D. ①中反应前后MnO2化学性质改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有35.8g Na2CO3和NaHCO3混合物的溶液中加入200mL 某浓度的盐酸,恰好完全反应,生成8.96L CO2(标准状况)。问:
(1)原溶液中有__________mol Na2CO3,__________mol NaHCO3。
(2)盐酸的物质的量浓度_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,发生反应:2A(g)+B(s)![]() C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( )
C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( )
①单位时间内生成n molC,同时生成n mol D
②单位时间内生成n molD,同时生成2n mol A
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2:1:1
⑤v(A):v(C):v(D)=2:1:1
A. ②③ B. ②③④ C. ②⑤ D. ②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是

已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3 ℃,苯甲酸的熔点为121.7 ℃,沸点为249 ℃,溶解度为0.34 g;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:

试根据上述信息,判断以下说法错误的是( )
A. 操作Ⅰ是萃取分液
B. 乙醚溶液中所溶解的主要成分是苯甲醇
C. 操作Ⅱ蒸馏所得产品甲是苯甲醇
D. 操作Ⅲ过滤得到产品乙是苯甲酸钾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com