
已知BrFn与水按3:5物质的量比反应,生成HF、HBrO3、O2和Br2,且O2和Br2物质的量相等.请回答:
(1)n= (2)氧化产物是 (3)1mol水可还原 mol BrFn?
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:单选题
水是生命之源,也是化学反应中的主角。请回答下列问题:
I.水是一种电解质,发生电离会产生电子总数相同的两种微粒,其电离方程式为 。
Ⅱ.在许多反应中H2O扮演不同的“角色”。请结合所学知识,写出有关反应的化学方程式或离子方程式。
(1)H2O参与置换反应,符合X+W→Y+V:
已知X和Y分别是短周期主族元素形成的两种单质, W、V是化合物。
①W是水,作还原剂,该反应的化学方程为 ;
②V是水,化学方程式为 。
(2)水在氧化还原反应既不是氧化剂也不是还原剂:
A、B是中学化学常见的两种由短周期元素组成的有色气体,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,写出A、B与水反应的化学方程式:
①A + H2O ;
②B + H2O ;
(3)某物质化学式为NH5,常温下是固态,能与水剧烈反应放出两种气体。在NH5中的各原子均具有稀有气体的稳定结构,则下列对NH5与水的反应描述正确的是 (填选项)。
A.NH5与水反应时,NH5是氧化剂
B.NH5与水反应时,NH5既是氧化剂又是还原剂
C.NH5与水反应时,NH5是还原剂
D.NH5与NH3溶于水后溶液均呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
制备食用碘盐(KIO3)原理之一为:I2 +2KClO3 Cl2 +2KIO3,下列说法正确的是
Cl2 +2KIO3,下列说法正确的是
| A.KClO3和KIO3均属于离子化合物,只含有离子键 |
| B.反应过程中I2置换出Cl2,由此可推断非金属性I>Cl |
| C.为防止反应的尾气造成大气污染,可以用饱和食盐水吸收尾气 |
| D.制备KIO3的反应中I2被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知P单质在KOH溶液中的变化是:4P+3KOH+3H2O=3KH2PO2+PH3↑,下列说法正确的是
| A.产物PH3分子中所有的原子可能共平面 |
| B.该反应中P做还原剂,H2O做氧化剂 |
| C.相关元素的第一电离能的大小顺序:S>P>Si |
| D.该反应每发生0.3摩尔电子转移,PH3分子中就有0.3摩尔P-H键形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
判断下列有关化学基本概念的依据正确的是
| A.胶体:组成物质的直径是否在1nm~100nm之间 |
| B.氧化还原反应:反应前后元素的化合价是否发生了变化 |
| C.共价化合物:组成化合物的元素是否全部都是非金属元素 |
| D.化学变化:是否有热效应、颜色变化、气体或沉淀生成等四种实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)某氮肥厂氨氮废水中氮元素多以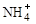 和NH3·H2O的形式存在,该废水的处理流程如下:
和NH3·H2O的形式存在,该废水的处理流程如下: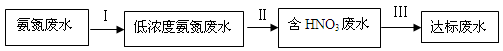
(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30 ℃,通空气将氨赶出并回收。用离子方程式表示加NaOH溶液的作用: 。
(2)过程Ⅱ:在微生物作用的条件下,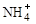 经过两步反应被氧化成
经过两步反应被氧化成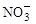 。其中第一步反应的能量变化示意图如下:
。其中第一步反应的能量变化示意图如下: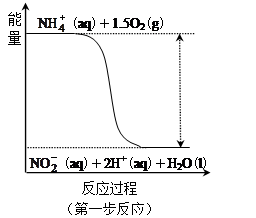
第一步反应是 反应(选填“放热”或“吸热”),判断依据是
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)将0.08mol KMnO4固体(质量为12.64g)加热一段时间后,收集到a molO2;向反应后残留的固体中加入足量的浓盐酸,又收集到b molCl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
(1)请配平下列方程式:
KMnO4+ HCl - KCl+ MnCl2+ Cl2↑+ H2O
(2)上式反应中的还原剂是 ,当还原剂失去1mol电子时,氧化产物的物质的量为 。
(3)a +b的最大值为 ,a +b最小值为 。
(4)当 a +b =0.18时,残留固体的质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)镍是一种十分重要的有色金属,但粗镍中一般含有Fe、Cu及难与酸、碱溶液反应的不溶性杂质而影响使用。现对粗镍进行提纯,具体的反应流程如下:
已知:
①2Ni2O3(黑色)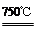 4NiO(暗绿色) + O2↑
4NiO(暗绿色) + O2↑
②
| 物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS |
| Ksp | 8.8×10-36 | 2.2×10-20 | 5.48×10-16 | 3.2×10-19 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中
共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为________。
(2)上述反应中的氧化剂是________,反应产生的气体可用________吸收。
(3)As2S3和HNO3有如下反应:As2S3+10H++10NO3—=2H3AsO4+3S↓+10NO2↑+2H2O,若生成2 mol H3AsO4,则反应中转移电子的物质的量为________。若将该反应设计成一原电池,则NO2应该在________(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2 L O2(标准状况)混合后用水吸收全部转化成浓硝酸,然后与过量的C反应,所产生的CO2的量________(选填编号)。
a.小于0.5 mol b.等于0.5 mol
c.大于0.5 mol d.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com