
【题目】如何降低大气中![]() 的含量及有效地开发利用
的含量及有效地开发利用![]() 引起了全世界的普遍重视。目前工业上有一种方法是用
引起了全世界的普遍重视。目前工业上有一种方法是用![]() 来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入
来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入![]() 和
和![]() ,在
,在![]() 下发生发应,
下发生发应,![]() 实验测得
实验测得![]() 和
和![]() 的物质的量浓度随时间变化如下所示:
的物质的量浓度随时间变化如下所示:
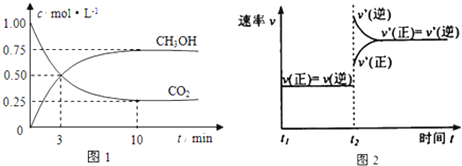
(1)从反应开始到平衡,氢气的平均反应速率![]() ______。500℃达平衡时,
______。500℃达平衡时,![]() 的体积分数为______,如上图是改变某条件时化学反应速率随时间变化的示意图,则该条件是______ 该反应的逆反应为______反应
的体积分数为______,如上图是改变某条件时化学反应速率随时间变化的示意图,则该条件是______ 该反应的逆反应为______反应![]() 填“放热”或“吸热”
填“放热”或“吸热”![]()
(2)500℃该反应的平衡常数为______![]() 保留两位小数
保留两位小数![]() ,若降低温度到300℃进行,达平衡时,K值______
,若降低温度到300℃进行,达平衡时,K值______![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]() .
.
(3)下列措施中能使![]() 的转化率增大的是______.
的转化率增大的是______.
A. 在原容器中再充入![]()
B. 在原容器中再充入![]() 和
和![]()
C. 在原容器中充入![]()
![]() 使用更有效的催化剂
使用更有效的催化剂
E. 将水蒸气从体系中分离出
(4)500℃条件下,改变起始反应物的用量,测得某时刻![]() 、
、![]() 、
、![]() 和
和![]() 的浓度均为
的浓度均为![]() ,则此时
,则此时![]() 正
正![]() ______
______![]() 逆
逆![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]()
(5)假定该反应是在恒容恒温条件下进行,判断该反应达到平衡的标志______.
A. 消耗![]() 同时生成1mol
同时生成1mol![]()
![]() 混合气体密度不变
混合气体密度不变
C. 混合气体平均相对分子质量不变
D.3v正(H2)=v逆(H2O)
E.![]() .不变
.不变
【答案】0.225mol/(L·min) ![]() 升高温度 吸热 5.33 增大 BE > CE
升高温度 吸热 5.33 增大 BE > CE
【解析】
根据速率之比等于化学计量数之比计算反应速率;根据平衡时各物质的浓度计算体积分数及平衡常数;根据平衡移动规律分析平衡的移动方向及判断反应是否到达平衡状态。
(1)v(CO2)=![]() =0.075mol/(L·min),v(H2)=3v(CO2)=0.075mol/(L·min)×3=0.225mol/(L·min);500℃达平衡时,n(CH3OH)=0.75mol/L×1L=0.75mol,n(H2O)=0.75mol,n(CO2)=0.25mol/L×1L=0.25mol,n(H2)=3mol-0.75mol×3=0.75mol,则
=0.075mol/(L·min),v(H2)=3v(CO2)=0.075mol/(L·min)×3=0.225mol/(L·min);500℃达平衡时,n(CH3OH)=0.75mol/L×1L=0.75mol,n(H2O)=0.75mol,n(CO2)=0.25mol/L×1L=0.25mol,n(H2)=3mol-0.75mol×3=0.75mol,则![]() 的体积分数为
的体积分数为![]() =
=![]() ;如图所示,正逆反应速率都增大,说明升高了反应温度,且逆反应速率增大的更多,平衡向逆方向移动,根据勒夏特列原理分析得,该反应的逆反应为吸热反应,故答案为:0.225mol/(L·min);
;如图所示,正逆反应速率都增大,说明升高了反应温度,且逆反应速率增大的更多,平衡向逆方向移动,根据勒夏特列原理分析得,该反应的逆反应为吸热反应,故答案为:0.225mol/(L·min);![]() ;升高温度;吸热;
;升高温度;吸热;
(2)500℃该反应的平衡常数为K ![]() =5.33;降低温度,平衡正方向移动,平衡常数增大,故答案为:5.33;增大;
=5.33;降低温度,平衡正方向移动,平衡常数增大,故答案为:5.33;增大;
(3)A. 在原容器中再充入1molCO2,平衡正方向移动,但![]() 的转化率减小,故A不选;
的转化率减小,故A不选;
B. 在原容器中再充入![]() 和
和![]() ,该反应为气体体积较小的反应,增大压强,平衡向正反应方向移动,所以
,该反应为气体体积较小的反应,增大压强,平衡向正反应方向移动,所以![]() 的转化率增大,故B选;
的转化率增大,故B选;
C. 在原容器中充入![]() ,平衡不移动,所以
,平衡不移动,所以![]() 的转化率不变,故C不选;
的转化率不变,故C不选;
![]() 使用更有效的催化剂,改变反应速率,但对平衡不影响,故D不选;
使用更有效的催化剂,改变反应速率,但对平衡不影响,故D不选;
E. 将水蒸气从体系中分离出,减小生成物浓度,平衡正向移动,故![]() 的转化率增大,故E选,故答案为BE;
的转化率增大,故E选,故答案为BE;
(4)![]() 、
、![]() 、
、![]() 和
和![]() 的浓度均为
的浓度均为![]() 时,Qc=
时,Qc=![]() <K,平衡正向移动,则此时
<K,平衡正向移动,则此时
(5)A.消耗![]() 和生成1mol
和生成1mol![]() 都表示正反应方向,故A不选;
都表示正反应方向,故A不选;
![]() 混合气体密度不变,该容器为恒容,所以气体密度始终不变,故B不选;
混合气体密度不变,该容器为恒容,所以气体密度始终不变,故B不选;
C.混合气体平均相对分子质量不变,该反应前后气体的物质的量不同,则相对分子质量不变说明反应物生成物浓度不变,说明反应已达到平衡,故C选;
D.反应中,速率之比等于化学计量数之比,若v正(H2)=3v逆(H2O),则说明反应达到平衡,故D不选;
E![]() .不变,说明生成物和反应物物质的量之比不变,能说明反应物和生成物浓度不变,故E选,故答案为CE。
.不变,说明生成物和反应物物质的量之比不变,能说明反应物和生成物浓度不变,故E选,故答案为CE。


科目:高中化学 来源: 题型:
【题目】mA(气) + nB(气) ![]() pC(气) + qD(气)的 C % 与时间t有如图关系
pC(气) + qD(气)的 C % 与时间t有如图关系
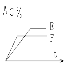
(1)若E、F表示两种温度,则 E____F ( 填 > 、< 或 = ),正反应____ 热
(2)若E、F表示两种压强,则 m + n_____p + q ( 填 > 、< 或 = )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中电解池两极材料分别为铁和石墨,通电一段时间后,右侧玻璃管中产生大量的白色沉淀。则下列说法正确的是

A. 石墨电极Ⅱ处的电极反应式为O2+4e-===2O2-
B. X是铁电极
C. 电解池中的电解液为蒸馏水
D. 若将电池两极所通气体互换,X、Y两极材料也互换,实验方案更合理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入![]() 和
和![]() ,一定条件下使反应
,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如图所示
达到平衡,正反应速率随时间变化的示意图如图所示![]() 由图得出的结论不正确的是
由图得出的结论不正确的是
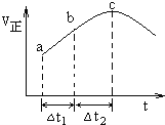
A. 反应过程中压强始终不变
B. 反应物浓度:a点大于b点
C. 反应物的总能量高于生成物的总能量
D. ![]() 时,
时,![]() 的转化率:
的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知:HCl是反应物之一。
①写出配平的该反应的化学方程式:_______________
②被氧化的元素是___________
(2)氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它.CuH具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是:2Cu+==Cu2++Cu.
根据以上信息,结合自己所掌握的化学知识,回答下列问题:
①写出CuH在氯气中燃烧的化学反应方程式:___________________________________.
②如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:__________________________________________________.
(3)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A. 1molHClO中所含H—Cl键的数目为NA
B. 8.8g乙酸乙酯中所含碳原子数为0.4NA
C. 1.2gC与0.1molCO2在高温下充分反应生成的CO分子数为0.1NA
D. 标准状况下,1L0.1mol·L-1HCl溶液中滴加氨水至pH=7,溶液中NH4+的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知100℃时,水的离子积常数Kw=1×10-12,对于该温度下pH=l1的氨水,下列叙述正确的是
A. 向该溶液中加入同温同体积pH=1的盐酸,反应后溶液呈中性
B. 温度降低至25℃,该氨水溶液中H2O电离出的H+浓度小于10-11mol/L
C. 该氨水溶液中加入NH4Cl溶液,NH3·H2O的电离能力增强
D. 滴加等浓度等体积的硫酸,得到的溶液中存在电离平衡:NH4HSO4(aq)![]() NH4+(aq)+H+(aq)+SO42-(aq)
NH4+(aq)+H+(aq)+SO42-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,主要不是从安全因素考虑的是
A. 点燃氢气前一定要检验氢气的纯度
B. 未使用完的白磷要随时收集起来,并与空气隔绝
C. 酒精灯不用时,必须盖上灯帽
D. 用氢气还原氧化铜时,要先通一会儿氢气,再加热氧化铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com